锂离子电池的应用很广 其正极材料可再生利用。某锂离子电池正极材料有钴酸锂(LiCoO2) 导电剂乙炔
锂离子电池的应用很广,其正极材料可再生利用。某锂离子电池正极材料有钴酸锂(LiCoO2)、导电剂乙炔黑和铝箔等。充电时,该锂离子电池负极发生的反应为6C+xLi++xe- = LixC6。现欲利用以下工艺流程回收正极材料中的某些金属资源(部分条件未给出)。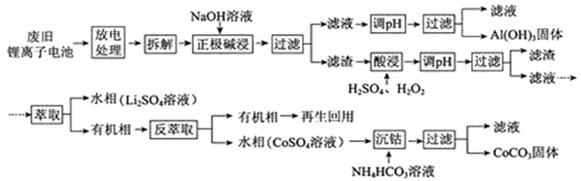 回答下列问题: (1)LiCoO2中,Co元素的化合价为 。 (2)写出“正极碱浸”中发生反应的离子方程式 。 (3)“酸浸”一般在80℃下进行,写出该步骤中发生的所有氧化还原反应的化学方程式 ;可用盐酸代替H2SO4和H2O2的混合液,但缺点是 。 (4)写出“沉钴”过程中发生反应的化学方程式 。 (5)充放电过程中,发生LiCoO2与Li1-xCoO2之间的转化,写出放电时电池反应方程式 。 (6)上述工艺中,“放电处理”有利于锂在正极的回收,其原因是 。在整个回收工艺中,可回收到的金属化合物有 (填化学式)。 |
参考解答
(1)+3 (2)2Al + 2OH- + 6H2O = 2Al(OH)- 4 + 3H2↑ (3)2LiCoO2 + 3H2SO4 + H2O2  Li2SO4 + 2CoSO4 + O2↑+ 4H2O Li2SO4 + 2CoSO4 + O2↑+ 4H2O2H2O2  2H2O + O2↑ ;有氯气生成,污染较大。 2H2O + O2↑ ;有氯气生成,污染较大。(4)CoSO4 + 2NH4HCO3 = CoCO3 ↓+ (NH4)2SO4 +CO2↑+ H2O (5) Li1-xCoO2 + LixC6 = LiCoO2 + 6C (6)Li+从负极中脱出,经由电解质向正极移动并进入正极材料中 Al(OH)3、CoCO3、Li2SO4 |
| 以工艺流程为背景考查化学反应原理中的电化学知识,包括电极反应式的书写、氧化还原反应,综合性较强。 (1)根据化合价代数和为0的原则,LiCoO2中Li为+1价,O为-2价,iCo元素的化合价为+3。 (2)根据工艺流程和相关产物可知,锂离子电池正极材料中只有铝箔与氢氧化钠反应,发生反应的离子方程式2Al + 2OH- + 6H2O = 2Al(OH)- 4 + 3H2↑。 (3)根据“酸浸”的反应物和反应条件,发生的所有氧化还原反应的化学方程式为;2LiCoO2 + 3H2SO4 + H2O2  Li2SO4 + 2CoSO4 + O2↑+ 4H2O,H2O2自身发生分解反应,2H2O2 Li2SO4 + 2CoSO4 + O2↑+ 4H2O,H2O2自身发生分解反应,2H2O2 2H2O + O2↑;LiCoO2具有较强的氧化性,用盐酸代替H2SO4和H2O2的混合液,氯气生成,污染较大。 2H2O + O2↑;LiCoO2具有较强的氧化性,用盐酸代替H2SO4和H2O2的混合液,氯气生成,污染较大。(4)根据“沉钴”过程中反应物和产物,发生反应的化学方程式CoSO4 + 2NH4HCO3 = CoCO3 ↓+ (NH4)2SO4 +CO2↑+ H2O。 (5)充放电过程中,发生LiCoO2与Li1-xCoO2之间的转化,放电时负极发生的反应为LixC6-xe-=6C+xLi+,正极Li1-xCoO2 + xe- = LiCoO2 + xLi+,电池总反应方程式Li1-xCoO2 + LixC6 = LiCoO2 + 6C。 (6)进行放电处理时,Li+从负极中脱出,经由电解质向正极移动并进入正极材料中,有利于锂在正极的回收。根据整个工艺流程的化学反应原理,可回收到的金属化合物有Al(OH)3、CoCO3、Li2SO4三种。 【考点定位】工艺流程、电化学、离子方程式 |
相似问题
在钢铁腐蚀过程中 下列五种变化可能发生的是( )①Fe2+转化为Fe3+ ②O2被还原 ③产生H2
在钢铁腐蚀过程中,下列五种变化可能发生的是( )①Fe2+转化为Fe3+ ②O2被还原 ③产生H2④Fe(OH)3失水形成Fe2O3·H2O⑤杂质碳被氧化A.只有①和②B
银锌钮扣高能电池放电时的反应为: 下列有关说法中不正确的是[ ]A.可用稀硝酸做电解质溶液
银锌钮扣高能电池放电时的反应为:,下列有关说法中不正确的是[ ]A.可用稀硝酸做电解质溶液 B.可用做负极 C.在正极上发生还原反应 D.该反应属于置换反应
利用如图所示装置可以模拟钢铁的电化学防护。下列说法正确的是A.若X为锌棒 开关K置于M处 铁极发生还
利用如图所示装置可以模拟钢铁的电化学防护。下列说法正确的是A.若X为锌棒,开关K置于M处,铁极发生还原反应B.若X为碳棒,开关K置于N处,X极发生还原反
关于下列各装置图的叙述中 不正确的是 A.用装置①精炼铜 则a极为粗铜 电解质溶液为CuSO4
关于下列各装置图的叙述中,不正确的是 A.用装置①精炼铜,则a极为粗铜,电解质溶液为CuSO4溶液B.用装置①进行电镀,镀件接在b极上C.装置②的总反应
下列关于电化学知识说法正确的是( )A.电解AlCl3 FeCl3 CuCl2的混合溶液 在阴极上
下列关于电化学知识说法正确的是( )A.电解AlCl3、FeCl3、CuCl2的混合溶液,在阴极上依次析出Cu、Fe、AlB.电解CuSO4溶液一段时间后,加入适量Cu(O












