卤族元素的单质和化合物很多。(1)卤素原子与氢原子形成的共价键中 极性最强键的是_____。NaF
| 卤族元素的单质和化合物很多。 (1)卤素原子与氢原子形成的共价键中,极性最强键的是_____。NaF、MgF2、SiF4三种晶体的熔点从高到低的顺序是______。 (2)已知CsICl2不稳定,受热易分解,倾向于生成晶格能更大的物质,则它按下列_____式发生。 A.CsICl2=CsCl+ICl B.CsICl2=CsI+Cl2 (3)CH3Cl、BF3、SCl2三种分子中属于极性分子的是 ,ClO2-中心氯原子的杂化轨道类型为______,写出一种与SO32-互为等电子体的分子 。 (4)已知CaF2晶体(见图)的密度为ρg/cm3,NA为阿伏加德罗常数,相邻最近的 两个Ca2+的核间距为a cm,则CaF2的相对分子质量可以表示为___________。 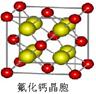 |
参考解答
| (1)H-F(1分) MgF2﹥NaF﹥SiF4 (2分) (2)A (2分) (3)CH3Cl、SCl2(2分) sp3杂化(2分) PCl3(或NCl3等)(2分) (4) 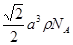 (2分) (2分) |
试题分析:(1)由于形成共用电子对的两元素的非金属性强弱相差越大,形成的共价键的极性越强;卤素原子与氢原子形成的共价键中,都含有氢原子,其它元素的非金属性大小关系为:F>Cl>Br>I,所以极性键的极性大小关系为:H-F>H-Cl>H-Br>H-I;NaF MgF2为离子晶体所以熔点高于分子晶体SiF4,在离子晶体中,离子的半径越小,晶格能越大;阴、阳离子所带电荷越多,晶格能越大,则晶体的熔点越高;电荷的影响大于半径的影响,所以NaF、MgF2、SiF4三种晶体的熔点从高到低的顺序是MgF2﹥NaF﹥SiF4。 (2)加热多卤化物则离解为简单的卤化物和卤素单质。CsBr3=CsBr+Br2,若为多种卤素的多卤化物,则离解生成具有最高晶格能的一种卤化物,如:CsICl2=CsCl+ICl,而不是CsI+Cl2,所以选A。 (3)组成为ABn型化合物,若中心原子A的化合价等于族的序数,则该化合物为非极性分子,所以BF3属于非极性分子,SCl2属于极性分子,CH3Cl空间结构为四面体形,不是正四面体,正负电荷的中心不重合,属于极性分子。ClO2-中价层电子对个数=2+1/2(7+1-2×2)=2,且含有2个孤电子对,所以空间构型是V型,sp3杂化;等电子体是指具有相同电子数目和原子数目的分子或离子,SO32-中有4个原子,6+6×3+2=26个价电子。 (4)该晶胞中含有钙离子个数=1/8×8+6×1/3 =4,氟离子个数=8,,相邻最近的两个Ca2+的核间距是正方体对角线的一半,所以正方体的边长为 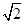 a cm,ρ= a cm,ρ= 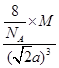 ,所以CaF2的相对分子质量可以表示为 ,所以CaF2的相对分子质量可以表示为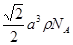 。 。 |
相似问题
关于反应K35ClO3+6H37Cl=KCl+3Cl2↑+3H2O的叙述中 正确的是 [ ]
关于反应K35ClO3+6H37Cl=KCl+3Cl2↑+3H2O的叙述中,正确的是 [ ]A.KCl中含有35Cl B.生成物Cl2的相对分子质量为73 3C.该反应转移的电子数为6e-D
下图是已经合成的著名的硫-氮化合物的分子结构。下列说法正确的是A.该物质的分子式为SNB.该物质的分
下图是已经合成的著名的硫-氮化合物的分子结构。下列说法正确的是A.该物质的分子式为SNB.该物质的分子中只有极性键,没有非极性键C.该物质分子中N-S
下列分子中划横线的原子采取的杂化方式为 sp杂化的是( )A.CH4B.C2H4C.C2H2D.N
下列分子中划横线的原子采取的杂化方式为 sp杂化的是( )A.CH4B.C2H4C.C2H2D.NH3
下列化合物中含有手性碳原子的是A.CCl2F2B.CH3CH3C.D.CH3CH2OH
下列化合物中含有手性碳原子的是A.CCl2F2B.CH3CH3C.D.CH3CH2OH
据报道 某些建筑材料会产生放射性同位素氡 从而对人体产生伤害 该同位素原子的中子数和质子数之差是 [
据报道,某些建筑材料会产生放射性同位素氡,从而对人体产生伤害,该同位素原子的中子数和质子数之差是 [ ]A.136B.50 C.86 D.222












