(10分) 能源短缺是人类社会面临的重大问题。甲醇是一种可再生能源 具有广泛的开发和应用前景。(1)
| (10分)、能源短缺是人类社会面临的重大问题。甲醇是一种可再生能源,具有广泛的开发和应用前景。 (1) 工业上一般采用下列两种反应合成甲醇: 反应Ⅰ:CO(g)+2H2(g)  CH3OH(g) CH3OH(g)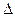 H1 H1反应Ⅱ:CO2(g)+3H2(g)  CH3OH(g)+H2O(g) CH3OH(g)+H2O(g)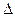 H2 H2①上述反应符合“原子经济”原则的是 (填“Ⅰ”或“Ⅱ”); ②下表所列数据是反应Ⅰ在不同温度下的化学平衡常数(K)。
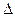 H1 0(填“>”“=”或“<”); H1 0(填“>”“=”或“<”);③某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应达到平衡后,测得c(CO)=0.2mol·L-1,则CO的转化率为 . (2)合成气经压缩升温后进入10m3甲醇合成塔,在催化剂作用下,通过反应Ⅰ进行甲醇合成,T4℃下此反应的平衡常数为160。此温度下,在密闭容器中加入CO、H2,反应  到某时刻测得各组分的浓度如下: 到某时刻测得各组分的浓度如下:
②若加入CO、H2后,在T5℃反应10min达到平衡,c(H2)=0.4 mol·L-1,则该时间内反应速率v(CH3OH) = mol·(L·min)-1。 (3)生产过程中,合成气要进行循环,其目的是 。 |
参考解答
| (10分)、⑴①Ⅰ(1分) ② < (1分) ③ 80% (2分) (2)①> (2分) ②0.03 mol·L-1·min-1。(2分) (3)提高原料利用率(或提高产量、产率亦可)。(2  分) 分) |
| 略 |
相似问题
在一定温度下 反应1/2H2(g)+ 1/2X2(g) HX(g)的平衡常数为10 若将1.0 mo
在一定温度下,反应1 2H2(g)+ 1 2X2(g) HX(g)的平衡常数为10,若将1 0 mol的HX(g)通入体积为1 0L的密闭容器中,在该温度时HX(g)的最大分解率接近于()A.5%B.17%C.25%D.33%
在固定体积的密闭容器中 进行如下化学反应:N2(g)+3H2(g)2NH3 (g)+ Q 其平衡常数
在固定体积的密闭容器中,进行如下化学反应:N2(g)+3H2(g)2NH3 (g)+ Q,其平衡常数K与温度T的关系如下表:T K298398498平衡常数K4 1×106K1K2①试判断K
对于可逆反应:2A(g)+B(g)2C(g) △H<0 下列各图正确的是( ) A
对于可逆反应:2A(g)+B(g)2C(g)△H<0,下列各图正确的是() A B C D
1 mol X气体跟a mol Y气体在体积可变的密闭容器中发生如下反应:X(g) + a Y(g)
1 mol X气体跟a mol Y气体在体积可变的密闭容器中发生如下反应:X(g) + a Y(g)b Z(g)反应达到平衡后,测得X的转化率为50%。而且,在同温同
在一密闭容器中 CO和H2O混合加热到800℃达到下列平衡:CO(g)+H2O(g)CO2(g)+H
在一密闭容器中,CO和H2O混合加热到800℃达到下列平衡:CO(g)+H2O(g)CO2(g)+H2(g) ,K=1 0,若反应开始时CO和H2O的浓度分别为0 20mol L和1 00mo












