海水综合利用的工艺流程图如下:(l)电解NaCl溶液 在电解槽中可直接得到的产品有H2
海水综合利用的工艺流程图如下: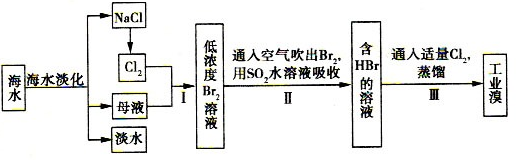 (l)电解NaCl溶液,在电解槽中可直接得到的产品有H2 、 或H2、 。 (2)步骤I中已获得Br2,步骤II中又将Br2还原为Br-,其目的是 。 (3)步骤II用SO2水溶液吸收Br2,吸收率可达95%,有关反应的离子方程式为 ,反应可知,除环境保护外,在工业生产中应解决的主要问题是 。 (4)分离出粗盐后的海水中蕴含着丰富的镁资源,经转化后可获得MgCl2粗产品。从海水中提取镁的步骤为: a.将海边大量存在的贝壳锻烧成石灰,并将石灰制成石灰乳; b.将石灰乳加人海水沉淀池中经过滤得到Mg(OH)2沉淀; c.在Mg(OH)2沉淀中加人盐酸得到MgCl2溶液,再经蒸发结品得到MgCl2· 6H2O; d.将MgCl2·6H2O在一定条件下加热得到无水MgCl2.电解熔融的氯化镁可得到Mg。 ①步骤d中的“一定条件”指的是 ,目的是 ; ②有同学认为:步骤b后可加热Mg(OH)2得到MgO,再电解熔融的MgO制金属镁,这样可简化生产步骤,体现简约性原则:你是否同意该同学的想法并说明理由: 。 |
参考解答
| (1)Cl2 NaOH NaClO (2)富集溴元素 (3)Br2+SO2+2H2O=4H++SO42-+2Br-(2分) 强酸对设备的严重腐蚀 (4)①在HCl气氛中 抑制MgCl2水解 ②不同意,因为MgO的熔点很高,熔融时会耗费大量的能量而增加成本。 |
试题分析:(1)电解NaCl溶液,在电解槽中可直接得到的产品有H2、Cl2、NaOH,若产物充分混合则Cl2与NaOH反应生成NaClO;(2)步骤I中已获得Br2是低浓度的,需要进一步富集达到工业生产的目的;)(3)反应产生强酸,具有腐蚀作用;(4)将MgCl2·6H2O在加热时会发生水解,故应在HCl气氛中加热,抑制MgCl2水解;因为MgO的熔点很高,熔融时会耗费大量的能量而增加成本,所以采用电解MgCl2。 |
相似问题
除去下列括号内杂质的试剂和方法正确的是A.Fe3+ (Al3+) 加过量的氨水 过滤B.KCl溶液(
除去下列括号内杂质的试剂和方法正确的是A.Fe3+ (Al3+),加过量的氨水,过滤B.KCl溶液(BaCl2),加入足量K2SO4溶液,过滤C.CO2 (SO2),饱和碳酸钠溶
下列溶液中离子的检验方法和结论相符的一组是序号检验方法结论A向一种未知溶液中加入硝酸酸化的BaCl2
下列溶液中离子的检验方法和结论相符的一组是序号检验方法结论A向一种未知溶液中加入硝酸酸化的BaCl2溶液,有白色沉淀生成未知溶液中一定含有SO42—B向一
下列仪器常用于物质分离的是A.①③⑤B.②③⑤C.②④⑤D.①④⑥
下列仪器常用于物质分离的是A.①③⑤B.②③⑤C.②④⑤D.①④⑥
下列有关实验的做法错误的是A.分液时 分液漏斗中的上层液体应由上口倒出B.用加热的方法可区分碳酸钠和
下列有关实验的做法错误的是A.分液时,分液漏斗中的上层液体应由上口倒出B.用加热的方法可区分碳酸钠和碳酸氢钠两种固体C.用渗析的方法可除去Fe(OH)3
溴苯是一种化工原料 实验室合成溴苯的装置示意图及有关数据如下: 苯溴溴苯密度/g·cm-30.883
溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:苯溴溴苯密度 g·cm-30 883 101 50沸点 ℃8059156水中溶解度微溶微溶微溶按下列合成步












