实验室制取乙烯 常因温度过高而使乙醇和浓硫酸反应生成少量的SO2。某同学设计下列实验以确定上述混合气
实验室制取乙烯,常因温度过高而使乙醇和浓硫酸反应生成少量的SO2。某同学设计下列实验以确定上述混合气体中含有乙烯和SO2。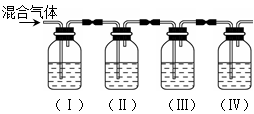 (1)I、II、III、IV装置可盛放的试剂是:I: II: III: IV: (请将下列有关试剂的序号填入空格内)。
使用装置II的目的是 ; 使用装置III的目的是 ; 确定含有乙烯的现象是 。 (3)Ⅳ中发生反应的化学方程式为 ;产物的名称是 。 |
参考解答
| (1) I:A II:B III:A IV:D (各1分,共4分) (2)I中品红溶液褪色(1分); 吸收SO2(1分); 证明SO2已经被完全吸收(1分); Ⅲ中品红不褪色,且IV中溶液颜色变浅或褪色(2分)。 (3)CH2=CH2 + Br2 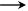 BrCH2CH2Br 、1,2—二溴乙烷 (4分) BrCH2CH2Br 、1,2—二溴乙烷 (4分) |
试题分析:(1)乙烯含有碳碳双键,能和溴水发生加成反应,也能被酸性高锰酸钾溶液氧化,溶液均是褪色的。但由于SO2具有还原性,能被溴水和酸性高锰酸钾溶液氧化,溶液也都是褪色的。所以首先检验的是SO2,且还要除去SO2。检验SO2的试剂是品红溶液,而除去SO2的试剂是氢氧化钠溶液。为了保证SO2已经完全被除去,需要再次提供品红溶液来检验SO2是否完全被除尽,即I、II、III、IV装置可盛放的试剂分别是品红溶液、氢氧化钠溶液、品红溶液和溴水,答案分别是A;B;A;D。 (3)乙烯和溴水发生加成反应生成1,2-二溴乙烷,反应的方程式是CH2=CH2 + Br2 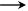 BrCH2CH2Br。2检验的有关实验探究 BrCH2CH2Br。2检验的有关实验探究点评:该题是中等难度实验题的考查,试题基础性强,侧重对学生实验能力的考查,有利于培养学生规范严谨的实验设计能力,有利于提升学生的学科素养。该类试题主要是以常见仪器的选用、实验基本操作为中心,通过是什么、为什么和怎样做重点考查实验基本操作的规范性和准确及灵活运用知识解决实际问题的能力。 |
相似问题
下列分离或提纯物质所用的方法不正确的是( ) A.用过滤的方法除去食盐水中的泥沙B.用分液的方法
下列分离或提纯物质所用的方法不正确的是( ) A.用过滤的方法除去食盐水中的泥沙B.用分液的方法分离乙醇和水的混合物C.用萃取的方法提取碘水中的碘D
鉴别Cl- Br- I-三种离子 不宜选用的试剂组是( )A.AgNO3溶液和稀硝酸B.溴水
鉴别Cl-、Br-、I-三种离子,不宜选用的试剂组是( )A.AgNO3溶液和稀硝酸B.溴水和淀粉溶液C.氯水和CCl4溶液D.氯水和淀粉溶液
从海水中可以提取溴 但得到的液溴中常溶有少量氯气 除去氯气应该采用的方法是A.加入适量的溴化钠溶液B
从海水中可以提取溴,但得到的液溴中常溶有少量氯气,除去氯气应该采用的方法是A.加入适量的溴化钠溶液B.加入适量的KI溶液C.通入溴蒸气D.加入适量的
下列分离提纯方法不正确的是A.分离KNO3和氯化钠 常用结晶与重结晶B.分离I2和NaI的混合物 常
下列分离提纯方法不正确的是A.分离KNO3和氯化钠,常用结晶与重结晶B.分离I2和NaI的混合物,常用升华法C.分离乙醇中和水的混合物,常用蒸馏法D.苯和酸
为除去混在氯化钾中的少量硫酸钾和氯化钙杂质 需进行下列六项操作:①加水溶解 ②加热蒸发结晶 ③加入过
为除去混在氯化钾中的少量硫酸钾和氯化钙杂质,需进行下列六项操作:①加水溶解 ②加热蒸发结晶 ③加入过量氯化钡溶液 ④加入过量盐酸 ⑤加入过量碳












