(1)用脱脂棉包住约0.2g过氧化钠粉末 置于石棉网上 往脱脂棉上滴水 可观察到脱脂棉剧烈燃烧起来.
| (1)用脱脂棉包住约0.2g过氧化钠粉末,置于石棉网上,往脱脂棉上滴水,可观察到脱脂棉剧烈燃烧起来.由实验现象所得出的有关Na2O2和H2O反应的结论是:______ a:有氧气生成 b:反应放热. (2)Na2O2和H2O反应的化学方程式是______. (3)某研究性学习小组拟用如图的装置进行实验,以证明上述结论.用以验证结论a的实验方法是:______ (4)用以验证结论b的实验方法及现象是:______. 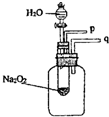 |
参考解答
| ( 1)脱脂棉剧烈燃烧说明具备燃烧的条件,试管内空气较少,若剧烈燃烧应该有大量氧气,只有该反应是放热反应才能使燃料温度达到着火点,根据题意知该反应有氧气生成且放热,故答案为:ab; (2)过氧化钠和水反应生成氢氧化钠和氧气,方程式为2Na2O2+2H2O=4NaOH+O2↑, 故答案为:2Na2O2+2H2O=4NaOH+O2↑; (3)氧气具有使带火星的木条复燃的性质,所以可用带火星的木条靠近p处,如果木条复燃,则有氧气生成,反之无氧气生成, 故答案为:打开活塞(或阀门)向试管内包有过氧化钠的石棉网上滴几滴水,用带火星的木条靠近p处,如果木条复燃,则有氧气生成,反之无氧气生成. (4)气体具有热胀冷缩的性质,如果该反应放热,放出的热量能使集气瓶内空气的压强增大;如果q导管插入盛水的小烧杯中,有气泡冒出,证明此反应放热. 故答案为:把q导管插入盛水的小烧杯中,有气泡冒出. |
相似问题
把一小块金属钠投入到饱和石灰水中 不会出现的现象是A.溶液中出现白色浑浊物B.有金属钙被还原出来
把一小块金属钠投入到饱和石灰水中,不会出现的现象是A.溶液中出现白色浑浊物B.有金属钙被还原出来< PGN0014B TXT PGN>C.反应过程中易发生爆炸D.钠熔
氢化钠(NaH)是一种白色离子晶体 其中钠是+1价 NaH与水反应放出H2 下列叙述中正确的是 A
氢化钠(NaH)是一种白色离子晶体,其中钠是+1价,NaH与水反应放出H2,下列叙述中正确的是A.NaH在水中显酸性B.NaH中氢离子的电子层排布与氦原子相同C.
在研究金属钠与氧气的反应时 将2.3 g金属钠在干燥的空气中氧化后 得到3.5 g固体 由此可判断其
在研究金属钠与氧气的反应时,将2 3 g金属钠在干燥的空气中氧化后,得到3 5 g固体,由此可判断其氧化产物为()A.只有Na2O2B.只有Na2OC.Na2O和Na2O2D.无法确定
如图所示装置 试管中盛有水 气球a盛有干燥的固体过氧化钠颗粒 U形管中注有浅红色的水已知 过氧化钠与
如图所示装置,试管中盛有水,气球a盛有干燥的固体过氧化钠颗粒,U形管中注有浅红色的水已知,过氧化钠与水反应是放热的.将气球用橡皮筋紧缚在试管口,
向紫色石蕊溶液中加入过量Na2O2粉末 振荡 可观察到的现象为 [ ]A.溶液仍为紫色
向紫色石蕊溶液中加入过量Na2O2粉末,振荡,可观察到的现象为 [ ]A 溶液仍为紫色B 溶液最终变为蓝色 C 最终溶液褪色,而无其他现象D 溶液中有气泡产生












