Na2O2与水的反应实际是Na2O2+2H2O═2NaOH+H2O2 反应放热 反应放出的热量使部分
| Na2O2与水的反应实际是Na2O2+2H2O═2NaOH+H2O2,反应放热,反应放出的热量使部分H2O2受热分2H2O2═2H2O+O2↑.为了测定某过氧化钠固体的纯度,今做如下实验:①称取过氧化钠固体2.00g;②把这些过氧化钠固体放入气密性良好的气体发生装置中;③向过氧化钠中滴加水,用某一量筒排水集气,量筒内液面在112mL处恰好与水槽内液面相平;④将烧瓶中的液体转移到250mL的容量瓶中,洗涤并将洗涤液也转入容量瓶,然后加入蒸馏水,定容,使液面恰好与刻度相切;⑤用移液管移取25.00mL容量瓶中的液体,放入锥形瓶中,用过量的稀硫酸酸化,然后用0.01mol/L的KMnO4溶液去滴定,至终点时用去了24.20mLKMnO4溶液(此时锰全部以Mn2+存在) (1)有500ml、250ml、150ml的量筒备用,应选用量程为______的量筒 (2)该实验应选用______(填“酸式”或“碱式”)滴定管 (3)在步骤③测量气体体积时,必须待烧瓶和量筒内的气体都冷却到室温时进行,此时量筒内的液面高于水槽中液面(如图),立即读数会使Na2O2的纯度______(填“偏高”“偏低”或“不变”);应进行的操作是______ (4)在步骤④中用到的仪器除了容量瓶外还需要______ (5)在步骤⑤中反应的离子方程式是______判定滴定达到终点的依据是______ (6)该过氧化钠的纯度为______(用百分数表示,保留一位小数;实验中得到的气体体积均看作为标准状况下) 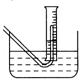 |
参考解答
| (1)用量筒时应选择体积接近的量筒,以减少误差,所以收集112mL气体应选择150mL的量筒,故答案为:150ml; (2)高锰酸钾是强氧化性的物质,应选择酸式滴定管,故答案为:酸式; (3)在步骤③测量气体体积时,必须待烧瓶和量筒内的气体都冷却到室温时进行,此时量筒内的液面高于水槽中液面,立即读数会使收集到的气体体积偏高,结果偏高,应慢慢把量筒往下移,使量筒中液面恰好与水槽中液面相平,故答案为:偏高;应慢慢把量筒往下移,使量筒中液面恰好与水槽中液面相平; (4)配制一定物质的量浓度的溶液需要的玻璃仪器:玻璃棒、胶头滴管,以及一定规格的容量瓶,故答案为:玻璃棒、胶头滴管; (5)高锰酸钾具有氧化性,双氧水具有还原性,二者可以发生氧化还反应,即2MnO4-+5H2O2+6H+=2Mn2++5O2↑+8H2O,高锰酸钾具有紫色,不需要指示剂来判断滴定终点,当溶液刚好出现浅紫红色,并在半分钟内不褪色,表明达到滴定终点,故答案为:2MnO4-+5H2O2+6H+=2Mn2++5O2↑+8H2O;溶液刚好出现浅紫红色,并在半分钟内不褪色; (6)双氧水分解掉的量,据2H2O2═2H2O+O2↑,当生成112mL氧气时,分解掉双氧水
|
相似问题
运用比较方法是化学科学中研究物质性质的基本方法之一 请运用比较法解答题目。过氧化钠几乎可与所有的常见
运用比较方法是化学科学中研究物质性质的基本方法之一,请运用比较法解答题目。过氧化钠几乎可与所有的常见气态非金属氧化物反应。如:2Na2O2+2CO22Na2CO
可用于判断碳酸氢钠粉末中是否混有碳酸钠的实验方法是( )A.溶于水后滴加氯化钡稀溶液 观察有无白
可用于判断碳酸氢钠粉末中是否混有碳酸钠的实验方法是()A.溶于水后滴加氯化钡稀溶液,观察有无白色沉淀生成B.溶于水后滴加澄清石灰水,观察有无白色
以下各组物质的性质比较中 正确的是( )A.热稳定性:Na2CO3>NaHCO3>H2CO3B.
以下各组物质的性质比较中,正确的是()A.热稳定性:Na2CO3>NaHCO3>H2CO3B.溶解度:Na2CO3<NaHCO3<H2CO3C.熔点:Rb>K>Na>LiD.还原性:Rb<K<Na<Li
由A B两种常见化合物组成的混合物 其阳离子均为Na+ 它们相互转化关系如图所示(其他物质均略去)。
由A、B两种常见化合物组成的混合物,其阳离子均为Na+,它们相互转化关系如图所示(其他物质均略去)。根据以上关系,完成下列问题:(1)写出A、B、C、D
下列几种物质均能使品红褪色 其中有一种物质使品红褪色的原理与其他几种不同 该物质是[ ]A.
下列几种物质均能使品红褪色,其中有一种物质使品红褪色的原理与其他几种不同,该物质是[ ]A.过氧化钠 B.臭氧 C.二氧化硫 D.过氧化氢












