在密闭容器上 放入碳酸铵和氢氧化钠固体共A克 将容器加热至200℃ 经充分反应后 排出其中的气体 冷
| 在密闭容器上,放入碳酸铵和氢氧化钠固体共A克,将容器加热至200℃,经充分反应后,排出其中的气体,冷却称得剩余固体的质量为B克。问容器内碳酸铵和氢氧化钠各多少克? |
参考解答
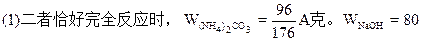 /176A克; 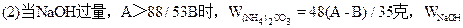 =(48B-13A)/35克; 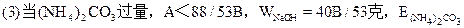 =A-40B/53克。 |
| 可能发生如下反应: (NH4)2CO3+2NaOH  2NH3↑+Na2CO3 ① 2NH3↑+Na2CO3 ①(NH4)2CO3  2NH3↑+CO2↑+H2O↑ ② 2NH3↑+CO2↑+H2O↑ ②在加热过程中应首先发生反应①,只有当(NH4)2CO3过量时才能继续发生反应②。并由以上反应可看出,NaOH过量时减重少。下面分别讨论。 (1)当二者恰好反应时: 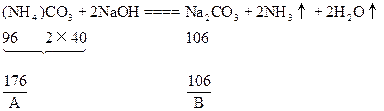 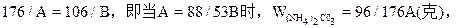 WNaOH=80/176A(克),(也可用B表示)。 (2)当NaOH过量,A>88/53B时,只发生反应①。先计算。(NH4)2CO3的量。 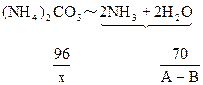 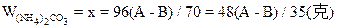 WNaOH=A-48(A-B)/53=(48B-13A)/35(克) (3)当(NH4)2CO3过量,A<88/35B时,发生反应①、②。 但由②知(NH4)2CO3全分解无固体剩余,所以还由①式计算,先求NaOH的量。 2NaOH~Na2CO3 ∴WNaOH=y=80B/106=40B/53(克), 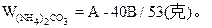 |
相似问题
在一个可以加热的密闭容器中 加入Na2O2和NaHCO3各0.5mol 将容器加热至400℃ 待充分
在一个可以加热的密闭容器中,加入Na2O2和NaHCO3各0 5mol,将容器加热至400℃,待充分反应后排出气体,则容器中剩余的固体是[ ]A Na2CO3B Na2CO3和Na2O2 C NaOHD Na2CO3和NaOH
不能用来鉴别Na2CO3和NaHCO3两种白色固体的实验操作是( )A.分别加热这两种固体物质
不能用来鉴别Na2CO3和NaHCO3两种白色固体的实验操作是()A.分别加热这两种固体物质,并将生成的气体通入澄清的石灰水中B.分别在这两种物质的溶液中,
将15.6gNa2O2与2.7gAl粉混合后 投入足量的水中 充分反应(设能产生的气体全部放出)。(
将15 6gNa2O2与2 7gAl粉混合后,投入足量的水中,充分反应(设能产生的气体全部放出)。(1)Na2O2与水反应的化学方程式为,该反应中的转移电子的物质的
化学美表现在很多方面 化学物质的美丽颜色就是其中一个重要的方面。下列物质中 有一种物质的颜色与其他三
化学美表现在很多方面,化学物质的美丽颜色就是其中一个重要的方面。下列物质中,有一种物质的颜色与其他三种的颜色不同,这种物质是()A.NaOHB.Na2OC
下列物质性质的比较 正确的是( )A.热稳定性:Na2CO3>NaHCO3>H2CO3B.熔点
下列物质性质的比较,正确的是( )A.热稳定性:Na2CO3>NaHCO3>H2CO3B.熔点:K>Na>LiC.溶解度:NaHCO3>Na2CO3D.氧化性:Li+<Na+<K+












