现有一种碱金属的碳酸正盐和另一种碱金属的酸式碳酸盐组成的混合物 取0.506 g加热至质量不再变化
| 现有一种碱金属的碳酸正盐和另一种碱金属的酸式碳酸盐组成的混合物,取0.506 g加热至质量不再变化,把放出的气体通入足量的澄清石灰水中,得到白色沉淀0.200 g。把加热后残留的固体与足量稀硫酸充分反应,生成的气体充分干燥后通过足量的过氧化钠粉末,结果过氧化钠粉末增重0.084 g。问: (1)混合物中酸式碳酸盐有________________mol。(不写计算过程) (2)加热灼烧后残留的固体含碳酸盐_______________mol。(不写计算过程) (3)通过计算,确定这两种盐的化学式,写出计算和推理过程。 |
参考解答
| (1)0.004 (2)0.003 (3)KHCO3、Na2CO3(推理过程略) |
| 碱金属盐混合物计算是高考的热点。在解此题的过程中必须应用关系式法、差量法这些技巧,并通过相对原子质量计算讨论推理。 (1)2MHCO3  M2CO3+H2O+CO2↑ M2CO3+H2O+CO2↑CO2+Ca(OH)2====CaCO3↓+H2O 2MHCO3—CaCO3 n(MHCO3)= 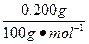 ×2='0.004' mol。 ×2='0.004' mol。(2)2CO2+2Na2O2====2Na2CO3+O2Δm 2 mol 56 g 0.003 mol 0.084 g 加热灼烧后残留的固体含碳酸盐0.003 mol。 (3)一种碱金属的碳酸正盐M′2CO3为0.001 mol,另一种碱金属的酸式碳酸盐MHCO3为0.004 mol (2M′+60) g·mol-1×0.001 mol+(M+61) g·mol-1×0.004 mol='0.506' g M′+2M=101 讨论可得:M′='23 ' M=39 所以为KHCO3和Na2CO3的混合物。 |
相似问题
为了制取干燥纯净的气体C 可用如下图所示装置。生成C的速度可通过调节滴入液体A的速度的方法来控制 已
为了制取干燥纯净的气体C,可用如下图所示装置。生成C的速度可通过调节滴入液体A的速度的方法来控制,已知C是一种无色无味、不能使酸碱指示剂变色,也不
下列关于碱金属元素的叙述正确的是( )A.它们都能在空气中燃烧生成M2OB.它们失去电子的能力很
下列关于碱金属元素的叙述正确的是()A.它们都能在空气中燃烧生成M2OB.它们失去电子的能力很强,故在自然界中无游离态存在C.它们的焰色反应都是黄色D
向含有下列各组离子的溶液中滴加NaOH溶液 得到白色沉淀的是()A.Ba2+ HCO- 3K+ Cl
向含有下列各组离子的溶液中滴加NaOH溶液,得到白色沉淀的是()A.Ba2+ HCO- 3K+ Cl-B.Na+ CO OH- NOC.Na+ OH- SO COD.Mg2+ NO- 3Na+ Cl-
有一在空气中暴露过的KOH固体 经分析知其内含:H2O 7.62% K2CO3 2.38% KOH
有一在空气中暴露过的KOH固体,经分析知其内含:H2O 7 62%,K2CO3 2 38%,KOH 90%。若将1 g此样品加入到含HCl 1 683 g的盐酸里,过量的酸再用足量的
下列说法不正确的是( )A.Na2CO3比NaHCO3易溶于水B.Na2CO3比NaHCO3稳定
下列说法不正确的是()A.Na2CO3比NaHCO3易溶于水B.Na2CO3比NaHCO3稳定C.Na2CO3和NaHCO3都能跟石灰水反应得到白色沉淀D.物质的量相等的Na2CO3和NaHCO












