下表为元素周期表的一部分 请参照元素①-⑧在表中的位置 用化学用语回答下列问题:族周期IA01①ⅡA
下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题:
(2)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是______. (3)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式:______. (4)⑥的单质与⑤的最高价氧化物的水化物发生反应的化学方程式:______. (5)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应:X溶液与Y溶液反应的离子方程式为______. 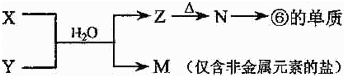 | ||||||||||||||||||||||||||||||||||||
参考解答
| 根据元素在周期表中的分布,可以知道①是H,②是C,③是N,④是O,⑤是Na,⑥是Al,⑦是Si,⑧是Cl (1)电子层越多半径越大,所以Na、Al>O,电子层一样多的原子,核电荷数越多半径越小,即Na>Al,故答案为:Na>Al>O; (2)②③是C、N,是同一周期元素的原子,根据元素周期律:从左到右最高价氧化物对应水化物的酸性逐渐增强,所以酸性:HNO3>H2CO3,②⑦是C、Si,是同主族元素,根据元素周期律:从上到下最高价氧化物对应水化物的酸性逐渐减弱,H2CO3>H2SiO3故答案为:HNO3>H2CO3>H2SiO3; (3)①④⑤⑧分别是H、O、Na、Cl,其中钠元素、氧原子、氢元素组成的氢氧化钠,钠元素、氧原子、氯元素组成的次氯酸钠,均是既含离子键又含极性共价键的化合物,电子式为:,Na+ 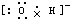 , 故答案为:Na+ 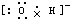 ; (4)⑥的单质Al与⑤Na的最高价氧化物的水化物NaOH发生反应生成偏铝酸钠和氢气,化学方程式为:2Al+2NaOH+2H2O=2NaOH+3H2↑,故答案为:2Al+2NaOH+2H2O=2NaOH+3H2↑; (5)由表中元素形成的常见物质X、Y、Z、M、N可发生如图转化的反应,其中M是仅含非金属的盐,所以一定是铵盐;Z
Al3++3NH3+3H2O=Al(OH)3↓+3NH4+;故答案为:Al3++3NH3+3H2O=Al(OH)3↓+3NH4+; |
相似问题
已知A是单质 E的水溶液显强酸性.A B C D E是含有一种相同元素的五种物质 在一定条件下可发生
已知A是单质,E的水溶液显强酸性.A、B、C、D、E是含有一种相同元素的五种物质,在一定条件下可发生下列的转化.则A可能是( )A.Cl2B.N2C.SD.C
某非金属单质A经如 A O2 B O2 C H2O D 所示的过程转化为含氧酸D 已知D为强酸 请回
某非金属单质A经如 A O2B O2C H2OD 所示的过程转化为含氧酸D,已知D为强酸,请回答:(1)若A常温下为淡黄色固体,B是有刺激性气味的无色气体.①写
符合如图所示的转化关系 且当X Y Z的物质的量相等时 存在焓变△H=△H1+△H2满足上述条件的X
符合如图所示的转化关系,且当X、Y、Z的物质的量相等时,存在焓变△H=△H1+△H2满足上述条件的X、Y可能是( )①C、CO②S、SO2③Na、Na2O④AlCl3、Al
某化学兴趣小组用只含有铝 铁 铜的工业废料制取纯净的氯化铝溶液 绿矾晶体[FeSO4?7H2O]和胆
某化学兴趣小组用只含有铝、铁、铜的工业废料制取纯净的氯化铝溶液、绿矾晶体[FeSO4?7H2O]和胆矾晶体,以探索工业废料的再利用.其实验方案如下:回答下
已知:A B D为中学化学常见的单质 甲 乙 丙 丁 戊为短周期元素组成的化合物。其中 丙是一种能使
已知:A、B、D为中学化学常见的单质,甲、乙、丙、丁、戊为短周期元素组成的化合物。其中,丙是一种能使湿润的红色石蕊试纸变蓝的无色气体;丁是一种高能












