(10分)(I)锌和铝都是活泼金属 其氢氧化物既能溶于强酸 又能溶于强碱。但是氢氧化铝不溶于氨水 氢
| (10分)(I)锌和铝都是活泼金属,其氢氧化物既能溶于强酸,又能溶于强碱。但是氢氧化铝不溶于氨水,氢氧化锌溶于氨水可以生成Zn(NH3)42+。回答下列问题: (1)写出锌和氢氧化钠溶液反应的化学方程式 。 (2)写出可溶性铝盐与过量氨水反应的离子方程式 。 试解释在实验室不适宜用可溶性锌盐与氨水反应制备氢氧化锌的原因 。 (II)环境专家认为可以用金属镁将水体中的NO 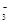 转化为N2,从而清除污染。该反应中涉及的粒子有:H2O、Mg、OH 转化为N2,从而清除污染。该反应中涉及的粒子有:H2O、Mg、OH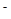 、Mg(OH)2、NO 、Mg(OH)2、NO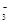 、N2,请将各粒子分别填入以下空格内(不用配平)。 、N2,请将各粒子分别填入以下空格内(不用配平)。 该反应过程中,被氧化与被还原的元素的物质的量之比为 。 |
参考解答
| (10分)(I)(1)Zn+2NaOH═Na2ZnO2+H2↑[或Zn+2NaOH+2H2O═Na2Zn(OH)4+H2↑(2分) (2)Al3++3NH3·H2O═Al(OH)3↓+3NH4+(2分) 可溶性锌盐与氨水反应产生的Zn(OH)2可溶于过量氨水中,生成Zn(NH3)42+,氨水的用量不易控制(2分) (II) NO 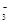 +Mg +H2O→Mg(OH)2+N2+OH-(2分)(不用配平,若配平不扣分,但配错不得分) 5:2(2分) +Mg +H2O→Mg(OH)2+N2+OH-(2分)(不用配平,若配平不扣分,但配错不得分) 5:2(2分) |
试题分析:本题给出的信息“锌的氢氧化物既能溶于强酸,又能溶于强碱。氢氧化锌溶于氨水可以生成Zn(NH3)42+。”学生没有学过,考查学生接受信息、处理信息的能力。 (1)锌与氢氧化钠反应可以类比铝与氢氧化钠反应:2Al+2H2O+2NaOH==2NaAlO2+3H2↑,则锌也生成类似的Na2ZnO2,所以方程式写成Zn+2NaOH═Na2ZnO2+H2↑[或Zn+2NaOH+2H2O═Na2Zn(OH)4+H2↑ (2)因为氢氧化铝只能溶于强酸和强碱溶液,不能溶于弱酸和弱碱,所以铝盐与氨水只能生成氢氧化铝沉淀,不能与氨水继续反应。 (3)利用信息“金属镁将水体中的NO 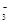 转化为N2”可以判断硝酸根离子是氧化剂、还原剂只能是镁,氧化产物是Mg(OH)2,还原产物是N2。写出初步反应物和生成物: 转化为N2”可以判断硝酸根离子是氧化剂、还原剂只能是镁,氧化产物是Mg(OH)2,还原产物是N2。写出初步反应物和生成物:NO 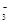 +Mg →Mg(OH)2+N2,根据原子守恒,则反应物中有H2O,生成物中有OH-,再根据化合价升降相等,被氧化的Mg元素与被还原的N元素物质的量之比为5:2。 +Mg →Mg(OH)2+N2,根据原子守恒,则反应物中有H2O,生成物中有OH-,再根据化合价升降相等,被氧化的Mg元素与被还原的N元素物质的量之比为5:2。点评:题干中出现学生在高中没有学习的知识点,一般要考查学生的自学能力,在短时间内接受新信息、运用所学知识结合新信息处理问题的能力,此时只要我们认真读题,同时回忆已学习的知识与之的联系,往往这样的题起点高,落点不高,属于中等难度。 |
相似问题
硫酸在下列用途或反应中所表现的性质(用字母填在横线上)。A.难挥发性B.强酸性C.吸水性D.脱水性
硫酸在下列用途或反应中所表现的性质(用字母填在横线上)。A.难挥发性B.强酸性C.吸水性D.脱水性 E.强氧化性① 浓硫酸可用作气体干燥剂 ;② 往
自然界地表层原生铜的硫化物经氧化 淋滤作用后变成CuSO4溶液 向地下深层渗透遇到难溶的ZnS或Pb
自然界地表层原生铜的硫化物经氧化、淋滤作用后变成CuSO4溶液,向地下深层渗透遇到难溶的ZnS或PbS,慢慢转变为铜蓝(CuS)。下列分析一定正确的是()A.
从海水中提取溴的反应原理是5NaBr + NaBrO3 + 3H2SO4 = 3Br2 + 3Na2
从海水中提取溴的反应原理是5NaBr + NaBrO3 + 3H2SO4 = 3Br2 + 3Na2SO4 + 3H2O,下列反应的原理与上述反应最相似的是A.2NaBr + Cl2 =" 2N
氧化还原反应是重要的反应类型 下列有关说法正确的是A.1molAl和足量的NaOH溶液反应 失去的电
氧化还原反应是重要的反应类型,下列有关说法正确的是A.1molAl和足量的NaOH溶液反应,失去的电子数为3NA(NA表示阿伏加德罗常数)B.原电池的负极发生氧化
(9分)(1)在反应K2Cr2O7+14HCl=2KCl+2CrCl3+3Cl2↑+7H2O中
(9分)(1)在反应K2Cr2O7+14HCl=2KCl+2CrCl3+3Cl2↑+7H2O中, ___元素被氧化,____元素被还原,是氧化剂;是还原产物(填相应的元素符号或化学式);












