已知铜能被稀硝酸溶解 其反应的化学方程式如下3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2
| 已知铜能被稀硝酸溶解,其反应的化学方程式如下 3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O (1)用双线桥法分析上述反应的电子转移情况(只需标出电子得失的方向和数目)__________________________________________________________________。 (2)上述反应中氧化剂是 ,氧化产物是 。 (3)上述反应中氧化剂与还原剂的物质的量之比为 。 (4)若反应中转移了0.6 mol电子,产生的气体在标准状况下的体积是 。 |
参考解答
(1)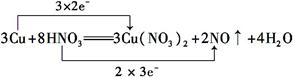 (2)HNO3 Cu(NO3)2 (3)2∶3 (4)4.48 L |
试题分析:(1)在反应3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O中,Cu元素的化合价由0升高到+2价,N元素的化合价由+5降低为+2价,转移的电子为6e-, 则双线桥法标出电子得失的方向和数目为  , ,故答案为: 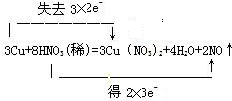 ; ;(2)N元素的化合价降低,Cu元素的化合价升高,则硝酸为氧化剂,硝酸铜为氧化产物;(3)生成硝酸盐体现硝酸的酸性,生成NO体现硝酸的氧化性,由反应及氮原子守恒可知,8mol硝酸反应时6mol硝酸体现酸性,2mol硝酸体现氧化性,3mol铜体现了还原性,故氧化剂与还原剂的物质的量之比为2:3;(4)由反应可知生成2molNO转移的电子为6mol,则反应中转移了0.6mol电子,产生的气体的物质的量为0.2mol,其在标准状况下的体积为0.2mol×22.4L/mol=4.48L。 |
相似问题
用0.2mol/LNa2SO3溶液32mL 还原含2×10-3molX2O72-的溶液 过量的Na2
用0 2mol LNa2SO3溶液32mL,还原含2×10-3molX2O72-的溶液,过量的Na2SO3用0 1mol L KMnO4酸性溶液氧化(其中KMnO4被还原成Mn2+),共消耗KMnO4溶液1 6m
已知溶液中:还原性HSO3—>I— 氧化性:IO3—>I2>SO42—。在含3 mol NaHSO3
已知溶液中:还原性HSO3—>I—,氧化性:IO3—>I2>SO42—。在含3 mol NaHSO3的溶液中逐滴加入KIO3溶液,加入KIO3和析出I2的物质的量的关系如图所示,则
离子M2O7X-与S2-能在酸性溶液中发生如下反应:M2O7X- +3S2- +14H+==2M3+
离子M2O7X-与S2-能在酸性溶液中发生如下反应:M2O7X- +3S2- +14H+==2M3+ +3S? +7H2O,则M2O7X-中M的化合价为()A.+4B.+5C.+6D.+7
(5分)(1)在反应2KMnO4+16HBr===5Br2+2MnBr2+2KBr+8H2O中 还原
(5分)(1)在反应2KMnO4+16HBr===5Br2+2MnBr2+2KBr+8H2O中,还原剂是。(2)浓盐酸在反应KClO3+HCl―→KCl+ClO2+Cl2+(补充完整此项化学式及化学计量
已知氧化性Fe3+>I2。向Fe I 2溶液中通入一定量的Cl2 发生反应的离子方程式为:a Fe2
已知氧化性Fe3+>I2。向Fe I 2溶液中通入一定量的Cl2,发生反应的离子方程式为:a Fe2++b I-+c Cl2→d Fe3++ e I2+ f Cl- 。下列选项中的数












