已知:还原性HSO3->I- 氧化性IO3->I2。在含3 mol NaHSO3的溶液中逐滴加入KI
已知:还原性HSO3->I-,氧化性IO3->I2。在含3 mol NaHSO3的溶液中逐滴加入KIO3溶液。加入KIO3和析出I2的物质的量的关系曲线如右图所示。下列说法正确的是( )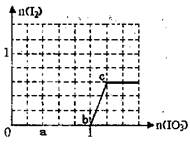
|
参考解答
| C |
| 根据题干可得以下方程式: IO3- + 3HSO3- = I- + 3SO42- + 3H+反应① IO3- + 5I- + 6H+ =3I2 + 3H2O 反应② 从图中可知 0~b之间发生反应①,b~c之间发生反应② a点IO3-为0.4 mol,参加反应的HSO3-为1.2 mol,剩余的NaHSO3的物质的量为1.8 mol;排除B; b点处第一个反应恰好完成,还原产物是I-,可以以KI或NaI的形式存在,故符合题意; 整个反应过程中氧化产物有SO42-和I2,排除A项; D项:设与I-反应的IO3- 的物质的量为x mol,则: IO3- + 3HSO3- = I- + 3SO42- + 3H+反应① 1 1 IO3- + 5I- + 6H+ =3I2 + 3H2O 反应② x 5x 3x 依题意,1-5x=3x,x = 1/8,此时共用KIO3是1+1/8='9/8' mol,排除D 故答案为C |
相似问题
在8NH3+3Cl2====6NH4Cl+N2反应中 若有2 mol N2生成 发生氧化反应的NH3
在8NH3+3Cl2====6NH4Cl+N2反应中,若有2 mol N2生成,发生氧化反应的NH3的物质的量是 ( )A.16 molB.8 molC.4 molD.3 mol
某溶液中C1- Br- I-的物质的量之比是2︰3︰4 要使溶液中的C1- Br- I-的物质的量之
某溶液中C1-、Br-、I-的物质的量之比是2︰3︰4,要使溶液中的C1-、Br-、I-的物质的量之比是4︰3︰2,则通入氯气的物质的量是原溶液中I-的物质的量的A.1
(4分)完成并配平下列化学方程式□FeO + □HNO3 → □Fe(NO3)3 + NO↑+ □
(4分)完成并配平下列化学方程式□FeO + □HNO3→ □Fe(NO3)3 + NO↑+ □,当生成2mol NO时,转移的电子数为NA。
对于氧化还原反应8Fe(NO3)2+10HNO3=8Fe(NO3)3+NH4NO3+3H2O 以下叙
对于氧化还原反应8Fe(NO3)2+10HNO3=8Fe(NO3)3+NH4NO3+3H2O,以下叙述错误的是()A.还原产物为NH4NO3B.氧化剂与还原剂的物质的量之比为8:1C.若有
(7分)储氢纳米碳管的研制成功体现了科技的进步。用电弧法合成的纳米管伴有大量的杂质——碳纳米颗粒。这
(7分)储氢纳米碳管的研制成功体现了科技的进步。用电弧法合成的纳米管伴有大量的杂质——碳纳米颗粒。这种碳纳米颗粒可用氧化法提纯。其原理可表示为:












