金属钙线是炼制优质钢材的脱氧脱磷剂 某钙线的主要成分为金属M和Ca 并含有3.5%(质量分数)CaO
| 金属钙线是炼制优质钢材的脱氧脱磷剂,某钙线的主要成分为金属M和Ca,并含有3.5%(质量分数)CaO. (1)Ca元素原子结构示意图______. (2)Ca与最活跃的非金属元素A形成化合物D,D的电子式为______,D的沸点比A与Si形成的化合物E的沸点______. (3)配平用钙线氧脱鳞的化学方程式: ______P+______FeO+______CaO
(4)将钙线试样溶于稀盐酸后,加入过量NaOH溶液,生成白色絮状沉淀并迅速变成灰绿色,最后变成红褐色M(OH)n.则检测Mn+的方法是______(用离子方程式表达). |
参考解答
(1)Ca是20号元素,元素的原子序数=其核外电子数=核内质子数,其核外电子排布是2,8,8,2,所以其原子结构示意图为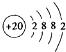 ,故答案为  . (2)、元素周期表中最活泼的非金属元素是F元素,与Ca形成化合物离子化合物D,所以D是CaF 2,其电子式为 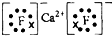 ;F与Si形成D的化合物E是SiF4,SiF4是共价化合物,所以D的沸点比E高. 故答案为: 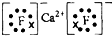 ;高; (3)该方程式中元素的化合价变化为:P→Ca3(PO4)2,磷元素由0价→+5价,一个磷原子失5个电子; FeO→Fe,铁元素由+2价→0价,一个 FeO得2个电子,根据氧化还原反应中得失电子数相等,所以其最小公倍数为10,故 P的计量数为2,FeO的计量数为5,其它元素根据原子守恒配平,所以该方程式为: 2 P+5 FeO+3 CaO
故答案为:2;5;3;1;5; (4)根据题意知M(OH)n为请氧化铁,Mn+为Fe 3+,Fe 3+ 的检验方法是:向溶液中加入KSCN溶液后,溶液变成血红色就说明原溶液有Fe 3+,该反应的离子方程式为Fe+3SCN-=Fe(SCN)3. 故答案为Fe+3SCN-=Fe(SCN)3 |
相似问题
单质铁溶于一定浓度的硝酸中反应的化学方程式如下aFe+bNO3-+cH+=dFe2++fFe3++g
单质铁溶于一定浓度的硝酸中反应的化学方程式如下aFe+bNO3-+cH+=dFe2++fFe3++gNO↑+hN2O↑+kH2O (化学计量数均为正整数)(1)c、g、h 的关系式是____
在8HNO3(稀)+3Cu===3Cu(NO3)2+2NO↑+4H2O反应中 (1)在上述化学方程式
在8HNO3(稀)+3Cu===3Cu(NO3)2+2NO↑+4H2O反应中,(1)在上述化学方程式中用双线桥标明电子转移的方向和数目。(2) 元素发生了还原反应,
已知Ca(OH)2与Cl2反应的氧化产物与温度有关 在一定量的石灰乳中通入一定量的氯气 二者恰好完全
已知Ca(OH)2与Cl2反应的氧化产物与温度有关,在一定量的石灰乳中通入一定量的氯气,二者恰好完全反应(发生的反应均为放热反应).生成物中含有Cl-、Cl
4.6 g Na与足量的水反应 反应中钠失去的电子数为 ( )
4 6 g Na与足量的水反应,反应中钠失去的电子数为()A 0 2B6 02 × 1023C 1 204 × 1023D0 1 mol
(NH4)2SO4在加热条件下分解 生成NH3 SO2 N2和H2O。反应中生成的氧化产物和还原产物
(NH4)2SO4在加热条件下分解,生成NH3、SO2、N2和H2O。反应中生成的氧化产物和还原产物的物质的量之比为……( ) A.1:3 B.2:3 C.1:1 D.4:3












