已知铜在常温下能被浓HNO3溶解 反应的化学方程式为Cu+4HNO3═Cu(NO3)2+2NO2↑+
| 已知铜在常温下能被浓HNO3溶解,反应的化学方程式为Cu+4HNO3═Cu(NO3)2+2NO2↑+2H2O (1)标出上面反应中的电子转移情况.______ (2)反应中生成1mol NO2,则被还原HNO3的物质的量为______. |
参考解答
(1)Cu+4HN03═Cu(N03)2+2NO2↑+2H20中,Cu元素的化合价由 0升高为+2价,N元素的化合价由+5价降低为+4价,该反应中转移2mol电子,则电子转移的方向和数目为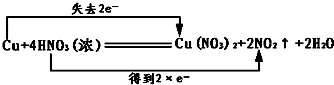 , ,故答案为:  ; ;(2)由反应可知,生成1mol气体就有1mol硝酸被还原,则反应中生成1mol NO2,则被还原HNO3的物质的量为1mol, 故答案为:1mol. |
相似问题
下列变化中 需加入还原剂才能实现的是( )A.AgNO3→AgClB.CuSO4→CuC.H2→H
下列变化中,需加入还原剂才能实现的是( )A.AgNO3→AgClB.CuSO4→CuC.H2→H2OD.CaO→Ca(OH)2
下列说法正确的是( )A.有单质参加或有单质生成的反应一定是氧化还原反应B.阳离子只有氧化性 阴离
下列说法正确的是( )A.有单质参加或有单质生成的反应一定是氧化还原反应B.阳离子只有氧化性,阴离子只有还原性C.失电子多的还原剂还原性强D.复
下列关于氧化还原反应的叙述中正确的是( )A.氧化还原反应的本质是化合价的升降 特征是电子的得失或
下列关于氧化还原反应的叙述中正确的是( )A.氧化还原反应的本质是化合价的升降,特征是电子的得失或电子对的偏移B.一部分复分解反应可能是氧化还
氧化还原反应的实质是( )A.分子中的原子重新组合B.氧元素的得失C.电子的得失或共用电子对的偏移
氧化还原反应的实质是( )A.分子中的原子重新组合B.氧元素的得失C.电子的得失或共用电子对的偏移D.化合价的改变
对于反应:TiCl4+4Na═4NaCl+Ti 下列说法正确的是( )A.该反应说明钠是强还原剂
对于反应:TiCl4+4Na═4NaCl+Ti,下列说法正确的是( )A.该反应说明钠是强还原剂,可用于冶炼金属B.该反应中Ti元素被氧化C.该反应条件是TiCl4在熔












