在酸性条件下 次氯酸钠(NaClO) 过氧化氢(H2O2)都有很强的氧化性 可将Fe2+氧化为Fe3
| 在酸性条件下,次氯酸钠(NaClO)、过氧化氢(H2O2)都有很强的氧化性,可将Fe2+氧化为Fe3+;在溶液中,Mg(OH)2和Fe(OH)2呈胶状物或絮状物沉淀;而MgCO3在水中煮沸可转化为更难溶的Mg(OH)2. “卤块”的主要成分为MgCl2,还含有FeCl2、FeCl3、MnCl2等杂质.若以它为原料,按图所示的工艺流程即可制得“轻质氧化镁”.并要求产品尽量不含杂质离子,而且成本较低,流程中加入的物质及其pH控制,都可参考下表1、表2来确定. 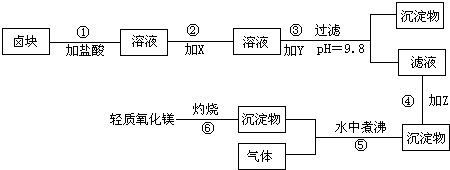 表1 生成氢氧化物沉淀时的pH
(1)写出在盐酸溶液中,NaClO将FeCl2氧化成FeCl3,同时生成NaCl和水的化学方程式______; 同时H2O2将FeCl2氧化成FeCl3,并生成了水,其化学方程式______. (2)在步骤②中加入的物质X,最佳的选择应是______,理由是______. (3)在步骤③中加入的物质Y应是______,之所以要控制pH=9.8,其目的是______. (4)在步骤④中加入的物质Z应是______. (5)在步骤⑤时发生的化学反应方程式是______. |
参考解答
| (1)NaClO将FeCl2氧化成FeCl3,同时生成NaCl和水,H2O2将FeCl2氧化成FeCl3,并生成了水,所以本题答案为:NaClO+2FeCl2+2HCl═2FeCl3+NaCl+H2O,H2O2+2HCl+2FeCl2═2FeCl3+2H2O; (2)要加入的X为过氧化氢或次氯酸钠,根据反应的原理可以看出,次氯酸钠作为氧化剂反应后生成氯化钠杂质,而过氧化氢生产的是水,且次氯酸钠的价格高于过氧化氢,所以加入过氧化氢合适,所以本题答案为:过氧化氢,价格低廉且反应后不生成新的杂质; (3)要得到较为纯净的氧化镁,需将卤块中含有的杂质除掉,根据表格提供的信息可以看出,氢氧化锰在pH为9.8时沉淀完全,故要控制pH=9.8,所以本题答案为:氢氧化钠,使FeCl3、MnCl2都转化为Fe(OH)3、Mn(OH)2沉淀,而大部分MgCl2尚未转化为Mg(OH)2,仍以MgCl2留在滤液中,达到分离杂质的目的; (4)MgCO3在水中煮沸可转化为更难溶的Mg(OH)2,所以加入的Z可以是碳酸钠,所以本题答案为:碳酸钠; (5)碳酸镁能与水在加热时生成氢氧化镁和二氧化碳,所以本题答案为:MgCO3+H2O
|
相似问题
铜及其化合物之间的转化如图所示 运用初中所学的知识分析 在一定条件下不能一步实现的是( )A.①B
铜及其化合物之间的转化如图所示,运用初中所学的知识分析,在一定条件下不能一步实现的是( )A.①B.②C.③D.④
要完成下列变化 能通过盐酸一步反应实现的是 [ ]A.Cu→CuCl2 B.Al2O3→A
要完成下列变化,能通过盐酸一步反应实现的是[ ]A.Cu→CuCl2B.Al2O3→AlCl3C.Fe2O3→FeCl2D.Fe→FeCl3
实验室制备CuCl2有多种方法 其中不可行的是 [ ]A.CuO+2HCl==CuCl2+H
实验室制备CuCl2有多种方法,其中不可行的是 [ ]A.CuO+2HCl==CuCl2+H2OB.Cu(OH)2+2HCl==CuCl2+2H2OC.CuSO4+BaCl2==CuCl2+BaSO4↓D.Cu+2HCl==CuCl2+H2↑
下列变化不能通过一步反应实现的是( )A.WO3→WB.CaCO3→Ca(OH)2C.FeO→Fe
下列变化不能通过一步反应实现的是( )A.WO3→WB.CaCO3→Ca(OH)2C.FeO→Fe(OH)2D.SO3→H2SO4
实验室制备FeCl3有多种方法 其中不可行的是[ ]A.Fe2O3+6HCl=2FeCl3+
实验室制备FeCl3有多种方法,其中不可行的是[ ]A.Fe2O3+6HCl=2FeCl3+3H2OB.Fe(OH)3+3HCl=FeCl3+3H2OC.Fe2(SO4)3+3BaCl2=2FeCl3十3BaSO4↓D.2Fe+6HCl=2FeCl3+3H2↑












