氧化还原反应在生产 生活中具有广泛的用途 贯穿古今。(1)下列生产 生活的事例中发生了氧化还原反应的
| 氧化还原反应在生产、生活中具有广泛的用途,贯穿古今。 (1)下列生产、生活的事例中发生了氧化还原反应的是 。 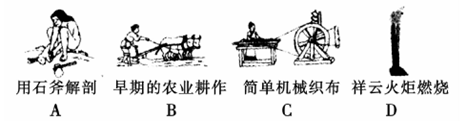 (2)水是人体的重要组成部分,是人体中含量最多的一种物质。而“四种基本反应类型与氧化还原反应的关系”也可用如图表达。 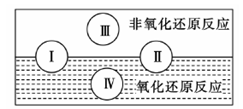 试写出有水参加、水为还原剂且为类型Ⅳ的一个化学方程式: 。 (3)NaNO2是一种食品添加剂,它能致癌。酸性KMnO4溶液与NaNO2反应的离子方程式是: 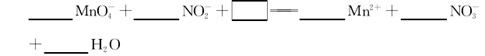 ①请补充完整,配平方程式并标出电子转移的方向和数目。 ②某同学称取了7.9 g KMnO4,固体,欲配制100 mL溶液。回答下列问题: 该实验中,使用容量瓶时要检查是否漏水,其操作是 。 ③不规范的实验操作会导致实验结果的误差。下列操作会使实验结果偏小的是 (填序号)。 A.在溶解过程中有少量液体溅出烧杯外 B.定容时仰视容量瓶上的刻度线 C.定容后,将容量瓶振荡摇匀后,静置发现液面低于刻度线,于是又加入少量水至刻度线 ④某同学用上述配好的KMnO4溶液滴定未知浓度的NaNO2溶液:取20 mL未知浓度的NaNO2溶液于锥形瓶;取上述配好的KMnO4溶液于________(填“酸式”或“碱式”)滴定管,滴定完成后消耗KMnO4溶液10 mL,则NaNO2溶液的浓度为________________。 |
参考解答
| (1)D (2) 2F2 + 2H2O =' 4HF' + O2 (3)① 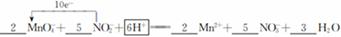 ②往容量瓶中加入少量的蒸馏水,盖上瓶塞,看瓶塞处是否漏水,放正,瓶塞旋转180度,重新倒置,看是否漏水 ③ABC ④酸式 0.625mol·L–1 ②往容量瓶中加入少量的蒸馏水,盖上瓶塞,看瓶塞处是否漏水,放正,瓶塞旋转180度,重新倒置,看是否漏水 ③ABC ④酸式 0.625mol·L–1 |
试题分析:(1)A、B、C都是物理变化,D燃烧是化学反应,且都属于氧化还原反应。(2)四种基本反应类型 中属于氧化还原反应的只有置换反应,水作还原剂,则只能氧元素被氧化,联系氟气与水的反应可写出化学方程式:2F2 + 2H2O =' 4HF' + O2。(3)①反应在酸性溶液中进行,所以方框中应补写H+;Mn的化合价降低5(+7到+2),N元素的化合价升高2(+3到+5),所以MnO4–和Mn2+都配2,NO2–和NO3–都配5,根据电荷守恒,H+配6,根据原子个数守恒H2O配3。②检查容量瓶是否漏水的方法为:往容量瓶中加入少量的蒸馏水,盖上瓶塞,倒置,看瓶塞处是否漏水,正立,瓶塞旋转180度,重新倒置,看是否漏水。③A、少量液体溅出烧杯外,造成溶质的物质的量减小,所配溶液浓度偏小;B、定容时仰视容量瓶上的刻度线,则加水过量,所配溶液浓度偏小;C、“又加入少量水至刻度线”会造成水量增加,溶液浓度偏小。故选ABC。④酸化KMnO4溶液有强氧化性,能氧化橡皮管,所以不用碱式滴定管而用酸式滴定盛装KMnO4溶液;从离子方程式可知KMnO4与NaNO2按2:5的物质的量之比反应,KMnO4的浓度为: 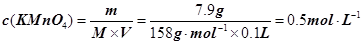 ,则NaNO2溶液的浓度为: ,则NaNO2溶液的浓度为: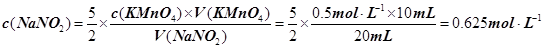 。 。 |
相似问题
在含Fe3+的溶液中加入铜粉与铁粉 充分反应发现溶液中有Cu2+存在 下列说法错误的是( )A.
在含Fe3+的溶液中加入铜粉与铁粉,充分反应发现溶液中有Cu2+存在,下列说法错误的是()A.容器中已肯定无Fe粉存在B.容器中肯定无Cu粉存在C.溶液中Fe
在FeO 与足量HNO3的反应中 HNO3 ( )A.只表现氧化性B.只表现还原性C.既表现
在FeO 与足量HNO3的反应中,HNO3( )A.只表现氧化性B.只表现还原性C.既表现氧化性又表现酸性的是D.既表现氧化性又表现还原性的是
下列说法正确的是 A.S02和Cl2都能使品红溶液褪色 且加热后均恢复原色B.Si02是酸性氧化物
下列说法正确的是A.S02和Cl2都能使品红溶液褪色,且加热后均恢复原色B.Si02是酸性氧化物,能与NaOH溶液反应C.高温时,CuO比Cu2O稳定D.将铜片放入浓硫
下列变化中需加入氧化剂才能发生的是A.2Cl-→Cl2B.Fe3+→Fe2+C.Cu2+→CuD.M
下列变化中需加入氧化剂才能发生的是A.2Cl-→Cl2B.Fe3+→Fe2+C.Cu2+→CuD.MnO→MnO2
水热法制备Fe3O4纳米颗粒的反应是3Fe2++2S2O+O2+xOH— Fe3O4+S4O+2
水热法制备Fe3O4纳米颗粒的反应是3Fe2++2S2O+O2+xOH—Fe3O4+S4O+2H2O,下列说法中,正确的是()A.每生成1mol Fe3O4,反应转移的电子总数为3mol ;B.












