在一定条件下 NO跟NH3可以发生反应生成N2和H2O.现有NO和NH3的混合物1mol 充分反应后
| 在一定条件下,NO跟NH3可以发生反应生成N2和H2O.现有NO和NH3的混合物1mol,充分反应后所得产物中,若经还原得到的N2比经氧化得到的N2多1.4g. (1)写出反应的化学方程式并标出电子转移的方向和数目. (2)若以上反应进行完全,试计算原反应混合物中NO与NH3的物质的量可能各是多少. |
参考解答
(1)反应的方程式为:6NO+4NH3=5N2+6H2O,反应中NO中N元素的化合价由+2价降低到0价,得电子,NH3中N元素的化合价由-3价升高到0价,失电子,氧化还原反应氧化剂和还原剂得失电子数目相等,则有: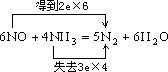 , 答: 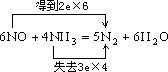 ; (2)6molNO还原得到3molN2,4molNH3,氧化得到2molN2,两者相差1molN2,现相差1.4g,
相当于0.3molNO和0.2molNH3反应, 依题意NO和NH3的总物质的量为1mol,其中必有一种为过量, 所以有两种情况:0.3molNO和0.7molNH3或0.2molNH3和0.8molNO. 答:原反应混合物中NO与NH3的物质的量可能为:0.3molNO和0.7molNH3或0.2molNH3和0.8molNO. |
相似问题
下列变化中 需加入适当的氧化剂才能完成的是( )A.Fe→FeCl2B.CuO→CuC.SO3→H
下列变化中,需加入适当的氧化剂才能完成的是( )A.Fe→FeCl2B.CuO→CuC.SO3→H2SO4D.HNO3→NO
氢化钙可以作为生氢剂(其中CaH2中氢元素为-1价) 反应方程式如下:CaH2+2H2O=Ca(OH
氢化钙可以作为生氢剂(其中CaH2中氢元素为-1价),反应方程式如下:CaH2+2H2O=Ca(OH)2+2H2↑,下列叙述正确的是( )A.标准状况下,生成22 4LH2转
维生素可根据其溶解性的不同分为______性维生素和______性维生素两大类.维生素C又称为抗坏血
维生素可根据其溶解性的不同分为______性维生素和______性维生素两大类.维生素C又称为抗坏血酸,在人体内有重要功能,其结构简式为则维生素C的分子式为_
下列反应中属于氧化还原反应 但水既不作氧化剂又不作还原剂的是( )A.2H2O 电解 . 2H2↑
下列反应中属于氧化还原反应,但水既不作氧化剂又不作还原剂的是( )A.2H2O电解 2H2↑+O2↑B.Cl2+H2O=HCl+HClOC.2F2+2H2O=4HF+O2D.2Na+2H2O=2NaOH+H2↑
下列反应中 既是化合反应 又是氧化还原反应的是( )(1)铁和氯气反应:2Fe+3Cl2═2FeC
下列反应中,既是化合反应,又是氧化还原反应的是( )(1)铁和氯气反应:2Fe+3Cl2═2FeCl3(2)氯气通入溴化钠溶液:Cl2+2NaBr═2NaCl+Br2(3)氯化












