利用海水可以提取溴和镁 提取过程如下。(1)提取溴的过程中 经过两次Br-→Br2转化的目的是___
利用海水可以提取溴和镁,提取过程如下。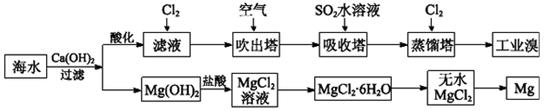 (1)提取溴的过程中,经过两次Br-→Br2转化的目的是________,吸收塔中发生反应的离子方程式是__________。用平衡移动原理解释通空气的主要目的是_______。 (2)从MgCl2溶液中得到MgCl2·6H2O晶体的主要操作是________________、过滤、洗涤、干燥。 (3)依据上述流程,若将10 m3海水中的溴元素转化为工业溴,至少需要标准状况下Cl2的体积为________L(忽略Cl2的溶解)。 |
参考解答
(1)对溴元素进行富集 SO2+Br2+2H2O=4H++2Br-+SO42— 通入空气将溴蒸气带出,使Br2(aq) Br2(g)平衡向右移动 (2)加热浓缩、冷却结晶 Br2(g)平衡向右移动 (2)加热浓缩、冷却结晶(3)179.2 |
| (2)由于得到的是MgCl2·6H2O,所以需要经过加热浓缩、冷却结晶、过滤等步骤,而不能直接将溶液蒸干。(3)10 m3海水中Br-的质量为104L×64×10-3 g·L-1=640 g,根据Cl2+2Br-=2Cl-+Br2,可知一次转化消耗89.6 L Cl2(标准状况下),两次需要179.2 L Cl2(标准状况下)。 |
相似问题
纤维素还原法制取ClO2是将纤维素水解得到的最终产物C6H12O6与NaClO3在酸性条件下反应生成
纤维素还原法制取ClO2是将纤维素水解得到的最终产物C6H12O6与NaClO3在酸性条件下反应生成ClO2。下列叙述中正确的是□C6H12O6+24NaClO3+12H2SO4=24ClO2↑+
向一洁净干燥的烧杯中加入44.4gAl粉与Fe粉混合物 然后加入过量的盐酸 产生标况下气体26.88
向一洁净干燥的烧杯中加入44 4gAl粉与Fe粉混合物,然后加入过量的盐酸,产生标况下气体26 88L。若将该混合物加入500mL14 mol·L-1的HNO3中(不考虑发生
下列说法不正确的是( )A.常温下 将铝片放入浓硝酸中 无明显现象 说明铝不与冷的浓硝酸反应B.元
下列说法不正确的是( )A.常温下,将铝片放入浓硝酸中,无明显现象,说明铝不与冷的浓硝酸反应B.元素由化合态变成游离态时,可能被氧化,也可能被
以下反应常用于合成电子 陶瓷工业常用的氮化铝(AlN)Al2O3+N2+3C 高温 . 2AlN+3
以下反应常用于合成电子、陶瓷工业常用的氮化铝(AlN)Al2O3+N2+3C高温 2AlN+3CO.下列有关说法正确的是( )A.氮化铝中氮元素化合价为-3B.该反应中
一定量的CuS和Cu2S的混合物投入足量的HNO3中 收集到气体V L(标准状况) 向反应后的溶液中
一定量的CuS和Cu2S的混合物投入足量的HNO3中,收集到气体V L(标准状况),向反应后的溶液中(存在Cu2+和)加入足量NaOH,产生蓝色沉淀,过滤,洗涤,灼烧












