离子反应是中学化学中重要的反应类型.回答下列问题:(1)在发生离子反应的反应物或生成物中 一定存在_
| 离子反应是中学化学中重要的反应类型.回答下列问题: (1)在发生离子反应的反应物或生成物中,一定存在______. ①单质 ②氧化物 ③电解质 ④盐 ⑤化合物 (2)可用图示的方法表示不同反应类型之间的关系.如分解反应和氧化还原反应可表示为下图.请在下面的方框中画出离子反应、置换反应和氧化还原反应三者之间的关系.  (3)离子方程式是中学生应熟练掌握的化学用语,请写出下列反应的离子方程式: 向Ba(HCO3)2溶液中滴入NaHSO4溶液,至沉淀完全,反应的离子方程式______. 在上述溶液中继续滴入NaHSO4溶液,此时离子方程式为______. |
参考解答
| (1)离子反应是由离子参加的反应,发生的条件是化合物在一定的条件下必须电离出能反应的离子,故答案为:③⑤; (2)置换反应都是氧化还原反应,离子反应部分是氧化还原反应,部分是非氧化还原反应,置换反应部分是离子反应,部分不是离子反应,其关系如图所示: 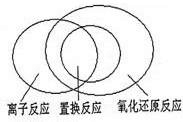 ,故答案为:  ; (3)向Ba(HCO3)2溶液中滴入NaHSO4,至沉淀完全的过程中,硫酸氢钠的量相对于Ba(HCO3)2溶液不足,所以碳酸氢钡有剩余,硫酸氢钠全反应,氢离子和硫酸根之间的物质的量之比是1:1,即发生反应:Ba2++SO42-+H++HCO3-=BaSO4++H2O+CO2↑;继续加硫酸氢钠,它电离出的氢离子又可以将多余的碳酸氢根离子反应掉,即H++HCO3-=H2O+CO2↑, 故答案为:Ba2++SO42-+H++HCO3-=BaSO4++H2O+CO2↑;H++HCO3-=H2O+CO2↑. |
相似问题
下列情况下的酸既表现出强氧化性 又表现了酸性的是( )A.常温下将木炭加入浓硫酸中B.氧化亚铁(F
下列情况下的酸既表现出强氧化性,又表现了酸性的是( )A.常温下将木炭加入浓硫酸中B.氧化亚铁(FeO)加入稀硝酸C.常温下将铜粉加入浓硝酸中D.氧
氧化还原反应中 水的作用可以是氧化剂 还原剂 既是氧化剂又是还原剂 既非氧化剂又非还原剂等.下列反应
氧化还原反应中,水的作用可以是氧化剂、还原剂、既是氧化剂又是还原剂、既非氧化剂又非还原剂等.下列反应与Br2+SO2+2H2O═H2SO4+2HBr相比较,水的作用
氮化钠和氢化钠与水反应的化学方程式如下:Na3N+3H2O→3NaOH+NH3 NaH+H2O→Na
氮化钠和氢化钠与水反应的化学方程式如下:Na3N+3H2O→3NaOH+NH3,NaH+H2O→NaOH+H2↑.有关Na3N和NaH的叙述正确的是( )A.离子半径:Na+>N3->H+B
在C+CO2=2CO中 C被______ 是______剂;CO2中的C元素化合价______ 被_
在C+CO2=2CO中,C被______,是______剂;CO2中的C元素化合价______,被______.
下列反应中 盐酸既表现出酸性又表现出还原性的是( )A.MnO2+4HCl(浓) △ . Mn
下列反应中,盐酸既表现出酸性又表现出还原性的是( )A.MnO2+4HCl(浓)△ MnCl2+Cl2↑+2H2OB.HCl+AgNO3=AgCl↓+HNO3C.Zn+2HCl=ZnCl2+H2↑D.2HCl电解 H2↑+Cl2↑












