(6分)请表示出下列方程式中电子转移的方向和数目 并回答下列问题5KI+KIO3+3H2SO4=3I
| (6分)请表示出下列方程式中电子转移的方向和数目,并回答下列问题 5KI+KIO3+3H2SO4=3I2+3K2SO4+3H2O (1)此反应中,氧化剂是 ,还原剂与氧化剂的物质的量之比是 (2)当生成1.5mol I2时转移的电子数是 |
参考解答
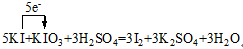 (1) KIO3;5:1 (2)2.5NA或1.505×1024 |
试题分析: 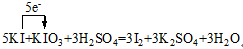 反应中元素化合价变化为: I:-1→0 失1×5e- I:+5→0 得5×1e- 氧化剂是KIO3、还原剂是KI,氧化剂与还原剂物质的量比为1:5。每生成3molI2转移电子数为5mol。 点评:氧化还原反应一定要分析清楚元素化合价变化。 |
相似问题
硫酸铵在强热条件下分解生成氨气 二氧化硫 氮气和水 3(NH4)2SO44NH3↑+3SO2↑+N2
硫酸铵在强热条件下分解生成氨气、二氧化硫、氮气和水 3(NH4)2SO44NH3↑+3SO2↑+N2↑+6H2O,反应中生成的氧化产物和还原产物的物质的量之比是A.1∶3
已知M2O7x-与S2-在酸性溶液中能发生反应:M2O7x-+3S2-+14H+=2M3++3S↓+
已知M2O7x-与S2-在酸性溶液中能发生反应:M2O7x-+3S2-+14H+=2M3++3S↓+7H2O,则M2O7x-中M元素的化合价是()A.+2B.+3C.+4D.+6
汽车剧烈碰撞时 安全气囊中发生反应:。则下列判断错误的是.A.该反应能在瞬间完成 并产生大量气体B.
汽车剧烈碰撞时,安全气囊中发生反应:。则下列判断错误的是.A.该反应能在瞬间完成,并产生大量气体B.生成标准状况下2.24L气体,该反应转移电子的物
下列说法正确的是A.MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O中 氧化剂和还原剂物质的量
下列说法正确的是A.MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O中,氧化剂和还原剂物质的量之比为1∶2B.2H2S+SO2=3S↓+2H2O中,氧化产物和还原产物物质的量之
三氟化氮(NF3)是一种无色 无味的气体 它是微电子工业技术的关键原料之一 可由氨气和氟气反应得到:
三氟化氮(NF3)是一种无色、无味的气体,它是微电子工业技术的关键原料之一,可由氨气和氟气反应得到:4NH3 +3F2=NF3 +3NH4F,它在潮湿的环境中能发生












