已知化学方程式7Cl2+14NaOH 9NaCl+4NaClO+NaClO3+7H2O试求
| 已知化学方程式 7Cl2+14NaOH 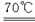 9NaCl+4NaClO+NaClO3+7H2O 9NaCl+4NaClO+NaClO3+7H2O试求在该反应中: (1)被氧化与被还原的氯原子数之比为多少? (2)当有49.7% g Cl2参与反应时,氧化产物的质量为多少克? |
参考解答
| (1)5∶9 (2)40.5 g。 |
(1)7  +14NaOH +14NaOH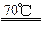 9Na 9Na  +4Na +4Na 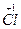 O+Na O+Na 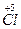 O3+7H2O O3+7H2O9个原子的化合价由0价变为-1价,化合价降低,被还原。4个Cl化合价由0价变为+1价,1个Cl化合价由0价变为+5价,5个Cl化合价升高,被氧化。 N被氧化(Cl)∶N被还原(Cl)=5∶9(化学上用“N”表示粒子个数)。 (2)(和量法):氧化产物为NaClO和NaClO3 7 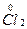 +14NaOH +14NaOH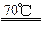 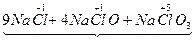 +7H2O +7H2O7×71.0 404.5 49.7g m(氧化产物) m(氧化产物)='40.5' g。 |
相似问题
下列变化需加入氧化剂才能实现的是 [ ]A.Fe3+ →Fe2+
下列变化需加入氧化剂才能实现的是[ ]A.Fe3+ →Fe2+B.CuO→Cu C.Cl-→Cl2D.H2SO4→BaSO4
下列叙述正确的是 [ ]A.发生化学反应时失去电子越多的金属原子 还原能力越强 B.金属阳离
下列叙述正确的是 [ ]A.发生化学反应时失去电子越多的金属原子,还原能力越强 B.金属阳离子被还原后,一定得到该元素的单质 C.核外电子总数相同的
Cl2在70 ℃的NaOH水溶液中 能同时发生两个自身氧化还原反应 反应完全后测得溶液中NaClO和
Cl2在70 ℃的NaOH水溶液中,能同时发生两个自身氧化还原反应,反应完全后测得溶液中NaClO和NaClO3的物质的量比为4∶1,则溶液中NaCl和NaClO的物质的量之
重铬酸铵〔(NH4)2Cr2O7〕是一种受热易分解的盐。下列各组对重铬酸铵受热分解产物的判断符合实际
重铬酸铵〔(NH4)2Cr2O7〕是一种受热易分解的盐。下列各组对重铬酸铵受热分解产物的判断符合实际的是()A.CrO3+NH3+H2OB.Cr2O3+NH3+H2OC.CrO3+N2+H2OD.Cr2O3+N2+H2O
某金属硝酸盐受热分解后生成三种物质 其中NO2和O2的物质的量之比为2∶1 在另一种物质中 金属的化
某金属硝酸盐受热分解后生成三种物质,其中NO2和O2的物质的量之比为2∶1,在另一种物质中,金属的化合价与反应前相比是()A.升高B.降低C.不变D.无法确定












