I NaOH FeCl3是中学化学实验室常用的试剂。(1)在一定条件下能与NaOH溶液反应的固体单质
| I、NaOH、FeCl3是中学化学实验室常用的试剂。 (1)在一定条件下能与NaOH溶液反应的固体单质有________和________(举两例)。 配制一定物质的量浓度的NaOH溶液时,造成实验结果偏低的原因是________。
______________________________________________. Ⅱ丙烷在燃烧时能放如大量的热,它也是液化石油气的主要成分,作为能源应用于人们 的日常生产和生活。 已知: 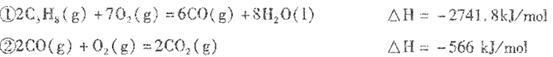 (1)反应 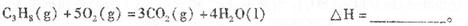 (2)依据(1)中的反应可以设计一种新型燃料电池,一极通人空气,另一极通入丙烷气体:燃料电池内部是熔融的掺杂着氧化钇(Y2O3)的氧化锆(ZrO2)晶体,在其内部可以传导O2-。在电池内部O2-移向_________极(填“正”或“负”);电池的负极反应为_____________________________. (3)用上述燃料电池用惰性电极电解足量Mg(NO3)2和NaCl的混合溶液。电解开始后阴极的现象为_______________________________________________。 |
参考解答
| Ⅰ(1)铝、硅(硫) B (2)2 Fe3+ +Cu='=2' Fe2+ + Cu2+ 3ClO-+2 Fe3++10OH-='2' FeO42-+3Cl-+5H2O Ⅱ(1)-2219.2KJ/mol (2)负 C3H8+10O2-—20e-=3CO2+4H2O (3)有大量无色气泡产生,并且有白色沉淀产生。 |
试题分析:(l)与NaOH溶液反应的固体单质有金属铝,和非金属单质硅硫。 配制一定物质的量浓度的NaOH溶液时,A.容量瓶中原有少量蒸馏水,不影响所配溶液浓度。B.洗涤烧杯和玻璃棒的溶液未转入容量瓶中,溶质减少,浓度减小。C. D操作都是所加溶剂少于正常读数的溶剂,所配溶液浓度偏大。 (2) FeCl3可以腐蚀电路铜板,就是Fe3氧化铜单质。 FeCl3 与KClO在强碱性条件下制备K2FeO4,利用KClO的强氧化性。 Ⅱ,(1)利用盖斯定律,(①+②×3)/2, C3H8(g)+5O2(g)=3CO2(g)+4H2O (l) △H=-2219.2KJ/mol (2)原电池电解质溶液中阴离子移向负极。电池的负极发生氧化反应。 (3) 用惰性电极电解足量Mg(NO3)2和NaCl的混合溶液,阴极发生还原反应,2H++2e-=H2↑,阴极周围溶液中2OH-+Mg2+=' Mg' (OH)2↓. |
相似问题
下列各组物质的稀溶液相互反应 无论是前者滴入后者 还是后者滴入前者 反应现象都相同的是A.NaHSO
下列各组物质的稀溶液相互反应,无论是前者滴入后者,还是后者滴入前者,反应现象都相同的是A.NaHSO4和Ba(OH)2B.AlCl3和NaOHC.NaAlO2和H2SO4D.Na2CO3和H2SO4
某同学对下列相应反应的离子方程式所作的评价 其中合理的是( )选项化学反应离子方程式评价A碳酸氢钠
某同学对下列相应反应的离子方程式所作的评价,其中合理的是( )选项化学反应离子方程式评价A碳酸氢钠的水解HC+H2OH3O++C正确BNaHCO3溶液中滴入NaOH溶液
(1)某一反应体系中有反应物和生成物共5种物质:S H2S HNO3 NO H2O;则该反应中还
(1)某一反应体系中有反应物和生成物共5种物质:S、H2S 、HNO3、NO 、H2O;则该反应中还原产物是_____;若反应过程中转移了0 3mol电子,则氧化产物的
著名化学家徐光宪获得2008年度“国家最高科学技术奖” 以表彰他在稀土萃取理论方面作出的贡献。稀土铈
著名化学家徐光宪获得2008年度“国家最高科学技术奖”,以表彰他在稀土萃取理论方面作出的贡献。稀土铈(Ce)元素主要存在于独居石中,金属铈在空气中易
下列各表述与示意图一致的是( )A.图①表示25℃时 用0.1 mol/L盐酸滴定20 mL 0
下列各表述与示意图一致的是()A.图①表示25℃时,用0.1 mol L盐酸滴定20 mL 0.1 mol L NaOH溶液,溶液的pH随加入酸体积的变化得到的滴定曲线B












