(1)根据下列几种粒子的结构示意图 回答问题:①其中属于阴离子的是______ 属于金属元素的是__
(1)根据下列几种粒子的结构示意图,回答问题: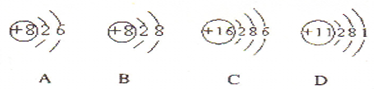 ①其中属于阴离子的是______,属于金属元素的是______.(填编号) ②试写出A、C、D三种元素形成的一种化合物在水溶液中的电离方程式______.______ (2)已知氢元素有11H、12H、13H三种核素,氧元素也有816O、817O、818O三种核素,则它们所形成的水分子共有______种. (3)实验室可以用高锰酸钾和浓盐酸反应制取氯气,反应的化学方程式如下:2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O] ①在该反应中,氧化剂是______,还原剂是______. ②当有0.20mol电子发生转移时,生成氯气的体积为______L(标准状况) |
参考解答
| (1)①阴离子是质子数小于核外电子数.故B表示阴离子;金属元素原子最外层电子数少于4,故D表示金属元素,故答案为:B;D; ②A、C、D的核内质子数分别为8、16、11,所以三种元素为O、S、Na,形成的化合物为Na2SO4或Na2SO3,均为可溶性的钠盐,是强电解质,电离方程式为:Na2SO4═2Na++SO42- (或Na2SO3═2Na++SO32-),故答案为:Na2SO4═2Na++SO42- (或Na2SO3═2Na++SO32-); (2)由氧的同位素有16O、17O、18O,氢的同位素有11H、12H、13H,在1个水分子中含有2个氢原子和1个氧原子, 若水分子中的氢原子相同, 则16O可分别与11H、12H、13H构成水,即存在三种水; 17O可分别与11H、12H、13H构成水,即存在三种水; 18O可分别与11H、12H、13H构成水,即存在三种水; 若水分子中的氢原子不同, 则16O可分别与11H12H、12H13H、11H13H构成水,即存在三种水; 17O可分别与11H12H、12H13H、11H13H构成水,即存在三种水; 18O可分别与11H12H、12H13H、11H13H构成水,即存在三种水; 所以共形成3×6=18种水,故答案为:18; (3)①2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O,通过化合价升降判断,Mn元素由+7价降低到+2价,Cl元素的化合价由-1价升高到0,高锰酸钾得电子是氧化剂,HCl失电子是还原剂,故答案为:KMnO4;HCl; (2)设反应中有0.20mol电子发生转移,生成氯气的体积为x, 2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O 转移电子10e-, 所以电子与氯气的关系式为10e-~5Cl2 10mol 5×22.4L 0.20mol x x=2.24L, 所以生成气体是2.24L,故答案为:2.24L. |
相似问题
现有三种可溶性物质A B C 其中有一种是碱 两种是盐 溶于水后电离产生的离子如下表所示:阳离子Na
现有三种可溶性物质A、B、C,其中有一种是碱,两种是盐,溶于水后电离产生的离子如下表所示:阳离子Na+H+Ba2+阴离子OH-CO32-SO42-为鉴别它们,分别完成一
下列离子方程式中正确的是( )A.铁与稀盐酸反应:Fe+2H+═Fe3++H2↑B.氯气与H2O反
下列离子方程式中正确的是( )A.铁与稀盐酸反应:Fe+2H+═Fe3++H2↑B.氯气与H2O反应:Cl2+H2O═2H++Cl-+ClO-C.钠与水反应:2Na+2H2O═2Na++2OH-+H
下列反应的离子方程式书写正确的是( )A.硫酸镁溶液和氢氧化钡溶液反应:SO42-+Ba2+═Ba
下列反应的离子方程式书写正确的是( )A.硫酸镁溶液和氢氧化钡溶液反应:SO42-+Ba2+═BaSO4↓B.等体积等物质的量浓度的NaHCO3和Ba(OH)2两溶液混
将一定体积的稀硝酸溶液平均分成两份 一份与足量的铜粉反应收集到气体的体积V1 另一份先加入与其等体积
将一定体积的稀硝酸溶液平均分成两份,一份与足量的铜粉反应收集到气体的体积V1,另一份先加入与其等体积的稀硫酸,再投入足量的铜粉收集到的气体的体积
某无色溶液 由Na+ Ba2+ Al3+ Cl- MnO4- CO32- NO3-中的若干种组成.
某无色溶液,由Na+、Ba2+、Al3+、Cl-、MnO4-、CO32-、NO3-中的若干种组成.,现取两份100mL溶液进行如下实验:①第一份小心蒸发得溶质3 08g;②第二份加












