(15分)雾霾含有大量的污染物SO2 NO。工业上变“废”为宝 吸收工业尾气SO2和NO 可获得Na
(15分)雾霾含有大量的污染物SO2、NO。工业上变“废”为宝,吸收工业尾气SO2和NO,可获得Na2S2O3和NH4NO3产品的流程图如下(Ce为铈元素):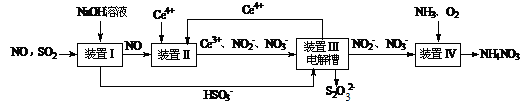 ⑴装置Ⅰ中的主要离子方程式为 。3 ⑵含硫各微粒(H2SO3、HSO3-和SO32-)存在于SO2与NaOH溶液反应后的溶液中,它们的物质的量分数X(i)与溶液pH 的关系如图所示。 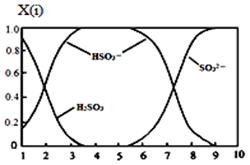 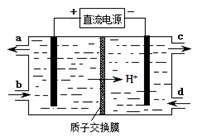 ①若是0.1molNaOH反应后的溶液,测得溶液的pH=8时,溶液中个离子由大到小的顺序是 。 ②向pH=5的NaHSO3溶液中滴加一定浓度的CaCl2溶液,溶液中出现浑浊,pH降为2,用化学平衡移动原理解释溶液pH降低的原因: 。 ⑶写出装置Ⅱ中,酸性条件下的离子方程式 。 ⑷装置Ⅲ还可以使Ce4+再生,其原理如下图所示。 ①生成Ce4+从电解槽的 (填字母序号)口流出。②写出与阴极的反应式 。 ⑸已知进入装置Ⅳ的溶液中,NO2-的浓度为a g·L-1,要使1 m3该溶液中的NO2-完全转化为NH4NO3,需至少向装置Ⅳ中通入标准状况下的O2 L。(用含a代数式表示, 计算结果保留整数) |
参考解答
| (1) SO2+OH-=HSO3-; (2) ①c(Na+)﹥c(SO32-)﹥c(HSO3-)﹥c(OH-)﹥c(H+) ;② HSO3-在溶液中存在电离平衡:HSO3-  SO32-+ H+,加CaCl2溶液后,Ca2++SO32-=CaSO3↓使电离平衡右移,c(H+)增大 SO32-+ H+,加CaCl2溶液后,Ca2++SO32-=CaSO3↓使电离平衡右移,c(H+)增大 (3) NO+2H2O+3Ce4+=3Ce3++NO3-+4H+;NO+H2O+Ce4+=Ce3++NO2-+2H+ (4) ①a ; ②2HSO3-+4H++4e-=S2O32-+3H2O (5)243a (242a、244a、5600a/23都给分) |
试题分析:⑴在置Ⅰ中SO2与NaOH溶液发生反应,离子方程式是SO2+OH-=HSO3-;(2)①溶液的pH=8时,溶液中含有的物质是Na2SO3和NaHSO3.根据物料守恒可得c(Na+)=(SO32-)+(HSO3-)+(H2O3);所以c(Na+)最大。知c(SO32-)﹥c(HSO3-)由于溶液显碱性,所以c(OH-)﹥c(H+);因为盐是强电解质,盐水解的程度是微弱的,所以c(HSO3-)﹥c(OH-)。故溶液中的离子浓度关系为:c(Na+)﹥c(SO32-)﹥c(HSO3-)﹥c(OH-)﹥c(H+);②NaHSO3溶液的pH=5,说明在溶液中NaHSO3的电离作用大于水解作用,当向其中加入CaCl2溶液时,会发生反应:Ca2++SO32-=CaSO3↓,这样就破坏了溶液中HSO3-在溶液中存在电离平衡:HSO3-  SO32-+ H+,使平衡正向移动,进行电离产生大量的H+;c(H+)增大,因此溶液的pH减小。pH降为2。⑶在装置Ⅱ中,在酸性条件下根据流程示意图可得反应的离子方程式是NO+2H2O+3Ce4+=3Ce3++NO3-+4H+;NO+H2O+ Ce4+=Ce3++NO2-+2H+;⑷在装置Ⅲ还可以使Ce4+再生,①由于Ce3+→Ce4+,化合价升高,失去电子,所以生成Ce4+从电解槽的阳极a流出;②在阴极发生的电极的反应式是2HSO3-+4H++4e-=S2O32-+3H2O。⑸由于NO2-的浓度为a g·L-1,所以1 m3该溶液中的NO2-的量为a g·L-1×1000L=1000ag.物质的量为1000ag÷46g/mol;每1mol的NO2-完全转化为NH4NO3,失去电子2mol.所以转移电子的物质的量为1000ag÷46g/mol×2=(1000a÷23)mol,每一mol的氧气反应转移电子4mol,所以消耗氧气的物质的量为(1000a÷23)mol÷4=(250a÷23)mol,需至少向装置Ⅳ中通入标准状况下的O2的体积是(250a÷23)mol×22.4L/mol=5600a/23L='243.' 5aL。 SO32-+ H+,使平衡正向移动,进行电离产生大量的H+;c(H+)增大,因此溶液的pH减小。pH降为2。⑶在装置Ⅱ中,在酸性条件下根据流程示意图可得反应的离子方程式是NO+2H2O+3Ce4+=3Ce3++NO3-+4H+;NO+H2O+ Ce4+=Ce3++NO2-+2H+;⑷在装置Ⅲ还可以使Ce4+再生,①由于Ce3+→Ce4+,化合价升高,失去电子,所以生成Ce4+从电解槽的阳极a流出;②在阴极发生的电极的反应式是2HSO3-+4H++4e-=S2O32-+3H2O。⑸由于NO2-的浓度为a g·L-1,所以1 m3该溶液中的NO2-的量为a g·L-1×1000L=1000ag.物质的量为1000ag÷46g/mol;每1mol的NO2-完全转化为NH4NO3,失去电子2mol.所以转移电子的物质的量为1000ag÷46g/mol×2=(1000a÷23)mol,每一mol的氧气反应转移电子4mol,所以消耗氧气的物质的量为(1000a÷23)mol÷4=(250a÷23)mol,需至少向装置Ⅳ中通入标准状况下的O2的体积是(250a÷23)mol×22.4L/mol=5600a/23L='243.' 5aL。考查:离子方程式的书写、离子浓度的比较、电解原理及应用、氧化还原反应的有关计算的知识。 |
相似问题
向含有0.2 mol NaOH和0.1 mol Ba(OH)2的溶液中持续稳定地通入CO2气体 当通
向含有0 2 mol NaOH和0 1 mol Ba(OH)2的溶液中持续稳定地通入CO2气体,当通入气体为8 96 L(0 ℃,1 01×105Pa)时立即停止,则这一过程中,溶液中离
下列离子方程式正确的是A.稀硝酸与氢氧化钾溶液反应H++OH一=H2OB.铝与稀盐酸反应Al+2H+
下列离子方程式正确的是A.稀硝酸与氢氧化钾溶液反应H++OH一=H2OB.铝与稀盐酸反应Al+2H+=Al3++H2↑C.三氯化铁溶液与氢氧化钠溶液反应FeCl3+3OH一=Fe(OH
揭示下列变化的离子方程式正确的是A.明矾用于净水:A3++3H2O=Al(OH)3↓+3H+B.钢铁
揭示下列变化的离子方程式正确的是A.明矾用于净水:A3++3H2O=Al(OH)3↓+3H+B.钢铁吸氧腐蚀的负极反应:Fe-3e-=Fe3+C.向明矾溶液中加入少量氢氧化钡溶
下列离子方程式书写正确的是( )。A.将SO2通入酸性KMnO4溶液:2MnO4-+5SO2+2H
下列离子方程式书写正确的是()。A.将SO2通入酸性KMnO4溶液:2MnO4-+5SO2+2H2O=2Mn2++5SO42-+4H+B.将Na2CO3溶液滴入等浓度等体积的盐酸中:CO
下列离子方程式书写正确的是A.单质铜与稀硝酸反应3Cu + 8H+ + 2NO3- = 3Cu2+
下列离子方程式书写正确的是A.单质铜与稀硝酸反应3Cu + 8H+ + 2NO3- = 3Cu2+ + 2NO↑+4H2O B.钠与水的反应 Na+2H2O=Na++2OH-+H2↑C.氯












