NH4Al(SO4)2是食品加工中最为快捷的食品添加剂 用于焙烤食品 工业上常用铝土矿(主要成分为A
NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品,工业上常用铝土矿(主要成分为Al2O3)来生产铵明矾NH4Al(SO4)2?12H2O,其工艺流程图如下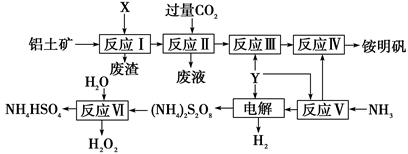 (1)流程图中X的电子式 , Y为 (填化学式)溶液 (2)反应Ⅱ的离子方程式为 (3)流程中可以循环使用的物质的名称是 (4)反应Ⅵ的化学方程式为 (5)对铵明矾NH4Al(SO4)2·12H2O高温分解的气体产物的预测不合理的是 。 A.NH3、N2、SO2、H2O B.NH3、SO3、H2O C.NH3、SO2、H2O D.NH3、N2、SO3、SO2、H2O (6)若同时制取铵明矾和硫酸铝,通过控制硫酸的用量调节两种产品的产量。若欲使制得的铵明矾和硫酸铝的物质的量之比为1:1,则投料时铝土矿中Al2O3和H2SO4的物质的量之比为____。 (7)向硫酸铝铵溶液中逐滴加入氢氧化钡溶液,不可能发生的反应是 A.4NH4Al(SO4)2+3Ba(OH)2=2(NH4)2SO4+3BaSO4↓+ Al2 (SO4)3+2Al(OH)3↓ B.2NH4Al(SO4)2+4Ba(OH)2=(NH4)2SO4+3BaSO4↓+Ba(AlO2)2 C.2NH4Al(SO4)2+3Ba(OH)2=(NH4)2SO4+3BaSO4↓+2Al(OH)3↓ D.NH4Al(SO4)2+2Ba(OH)2=NH3·H2O+2BaSO4↓+ Al(OH)3↓ |
参考解答
(1)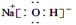 (2)CO2+AlO2-+2H2O=Al(OH)3+HCO3- (2)CO2+AlO2-+2H2O=Al(OH)3+HCO3- (3)硫酸氢铵(4)(NH4)2S2O8+2H2O=2NH4HSO4+H2O2(5)C (6)3:10(7)B |
试题分析:铝土矿的主要成分是氧化铝,与X反应后的溶液与二氧化碳反应,故X为氢氧化钠溶液,反应后生成的偏铝酸钠溶液可以和过量的二氧化碳反应生成氢氧化铝沉淀和碳酸氢钠溶液,故X为氢氧化钠;反应Ⅲ为氢氧化铝中加上Y可以制得NH4Al(SO4)2,需要有氢离子溶解氢氧化铝,还有硫酸根离子,故Y为H2SO4;(2)反应II为偏铝酸钠溶液和二氧化碳的反应;(3)由工艺流程转化可知,Y为H2SO4,反应Ⅴ生成NH4HSO4,反应Ⅳ中NH4HSO4转化为铵明矾,反应Ⅵ也产生NH4HSO4,可见NH4HSO4可以在反应中循环使用;(4)根据反应物和产物分析得出化学方程式;(5)根据氧化还原化合价有升有降可得C不正确,因为它只有降低,没有升高;(6)假设铵明矾和硫酸铝的物质的量各为1mol,设需要氧化铝的物质的量为x,硫酸的物质的量为y,根据原子守恒得关系式2x=3、y=5,故x:y=3:10;(7)氢氧根离子先与铝离子反应生成氢氧化铝,然后与铵根离子反应生成一水合氨,然后是氢氧化铝沉淀的溶解,故B错误;故选B。 |
相似问题
下表中评价合理的是选项内容评价A一定条件下0.5mol N2和1.5molH2反应 平衡时放热a
下表中评价合理的是选项内容评价A一定条件下0 5mol N2和1 5molH2反应,平衡时放热akJ,则N2(g)+3H2(g)2NH3(g)H=2akJ·mol-1正确B氯化镁溶液与氨水反
某工厂排出的污水中含有大量的Fe2+ Zn2+ Hg2+三种金属离子。以下是某化学研究性学习小组的同
某工厂排出的污水中含有大量的Fe2+、Zn2+、Hg2+三种金属离子。以下是某化学研究性学习小组的同学设计除去污水中的金属离子,并回收绿矾、皓矾(ZnSO4·
下列表示对应化学反应的离子方程式正确的是
下列表示对应化学反应的离子方程式正确的是()A.向银氨溶液中滴加乙醛:CH3CHO +2[Ag(NH3)2]+ + H2OCH3COO- + NH4+ +3NH3 + 2Ag↓+2H+B.苯酚
下列离子方程式书写正确的是:A.铜片跟稀硝酸反应:Cu+4H+ + NO3-=Cu2++NO↑+2H
下列离子方程式书写正确的是:A.铜片跟稀硝酸反应:Cu+4H+ + NO3-=Cu2++NO↑+2H2OB.AlCl3溶液中加入过量氨水:Al3++4OH-=AlO2-+2H2O C.FeBr2
请把符合要求的化学反应方程式的字母编号填入括号内。(1)是分解反应又是氧化还原反应的是( )
请把符合要求的化学反应方程式的字母编号填入括号内。(1)是分解反应又是氧化还原反应的是( ) (2)是分解反应不是氧化还原反应的是( ) (3)是化合反应又












