许多硫的含氧酸盐在医药 化工等方面有着重要的用途。(1)重晶石(BaSO4)常做胃肠道造影剂。已知:
| 许多硫的含氧酸盐在医药、化工等方面有着重要的用途。 (1)重晶石(BaSO4)常做胃肠道造影剂。已知:常温下,Ksp(BaSO4)=1.1×10-10。向BaSO4悬浊液中加入硫酸,当溶液的pH=2时,溶液中c(Ba2+)= ; (2)硫酸亚铁铵晶体[(NH4)2Fe(SO4)2·6H2O]常做分析剂。等物质的量浓度的四种稀溶液: a.(NH4)2Fe(SO4)2 b.NH4HSO4 c.(NH4)2SO4 d.(NH4)2SO3 其中c(NH4+)由大到小的顺序为 (填选项字母); (3)过二硫酸钾(K2S2O8)常做强氧化剂,Na2S2O3常做还原剂。 ①K2S2O8溶液与酸性MnSO4溶液混合,在催化剂作用下,可以观察到溶液变为紫色,该反应的离子方程式为 ; ②样品中K2S2O8的含量可用碘量法测定。操作步骤为称取0.3000 g样品于碘量瓶中,加50 mL水溶解;加入4.000 g KI固体(稍过量),振荡使其充分反应;加入适量醋酸溶液酸化,以 为指示剂,用0.1000 mol·L-1 Na2S2O3标准液滴定至终点(已知:I2+2S2O32-= 2I-+S4O62-)。重复2次,测得平均消耗标准液21.00 mL。该样品中K2S2O8的质量分数为(杂质不参加反应) _(结果保留三位有效数字)。 |
参考解答
(1)2.2×10-8mol/L( 未写单位不得分) (2)a>c>d>b (2)①5S2O32-+2Mn2++8H2O 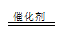 10SO42-+2MnO4-+16H+ (没写反应条件给分) 10SO42-+2MnO4-+16H+ (没写反应条件给分) ②淀粉 94.5% |
试题分析:(1)Ksp(BaSO4)=1.1×10-10,当溶液的pH=2时,c(SO42-) ='0.005' mol/L ,c(Ba2+)= Ksp(BaSO4)/ c(SO42-)=2.2×10-8mol/L ; (2)等物质的量浓度的四种稀溶液: a.(NH4)2Fe(SO4)2 ,c.(NH4)2SO4 ,d.(NH4)2SO3 中NH4+浓度大于b.NH4HSO4 ,a.Fe2+和NH4+水解相互抑制,d. NH4+和SO32-水解相互促进。所以c(NH4+)由大到小的顺序为a>c>d>b; (3)过二硫酸钾(K2S2O8)常做强氧化剂,①K2S2O8溶液与酸性MnSO4溶液混合,在催化剂作用下,可以观察到溶液变为紫色,Mn2+被氧化成MnO4-,S2O82-被还原,5S2O32-+2Mn2++8H2O 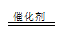 10SO42-+2MnO4-+16H+,②因为该反应涉及I2,可以用淀粉溶液作指示剂;由I2+2S2O32-= 2I-+S4O62-得关系: n(S2O82-)--2n(S2O32-);已知n(S2O32-)=2.1×10-3mol; 求得n(S2O82-)=1.05×10-3mol;w(K2S2O8)=270g/mol×1.05×10-3mol /0.3g×100℅=94.5% 10SO42-+2MnO4-+16H+,②因为该反应涉及I2,可以用淀粉溶液作指示剂;由I2+2S2O32-= 2I-+S4O62-得关系: n(S2O82-)--2n(S2O32-);已知n(S2O32-)=2.1×10-3mol; 求得n(S2O82-)=1.05×10-3mol;w(K2S2O8)=270g/mol×1.05×10-3mol /0.3g×100℅=94.5% |
相似问题
向含等物质的量两种溶质的甲溶液中逐渐加入乙物质 生成不溶物的量(Y)与加入物的量(X)之间的关系符
向含等物质的量两种溶质的甲溶液中逐渐加入乙物质,生成不溶物的量(Y)与加入物的量(X)之间的关系符合如图所示的是甲溶液乙物质AHCl和CaCl2NaHCO3溶
下列离子方程式正确的是( )A.向次氯酸钙溶液通入SO2:Ca2++2ClO?+SO2+H2O=
下列离子方程式正确的是()A.向次氯酸钙溶液通入SO2:Ca2++2ClO?+SO2+H2O= CaSO3↓+2HClO B.向NH4A1(SO4)2溶液中滴入Ba(OH)2溶液恰使SO42-沉淀完全
下列离子方程式正确的是( )A.乙酸与碳酸钠溶液反应:2H++CO== CO2↑+H2OB.醋酸
下列离子方程式正确的是()A.乙酸与碳酸钠溶液反应:2H++CO== CO2↑+H2OB.醋酸溶液与新制氢氧化铜反应:CH3COOH+OH— —→CH3COO-+H2OC.苯酚
下列离子方程式中正确的是A.Fe(OH)3滴加稀盐酸:OH- + H+=H2OB.向石灰乳[Ca(O
下列离子方程式中正确的是A.Fe(OH)3滴加稀盐酸:OH- + H+=H2OB.向石灰乳[Ca(OH)2]溶液通入过量的二氧化碳:Ca2++2OH- +CO2=CaCO3↓+H2OC.MgCl2溶
下列表示对应化学反应的离子方程式正确的是A.Ca(HCO3)2溶液与少量NaOH溶液反应: 2HCO
下列表示对应化学反应的离子方程式正确的是A.Ca(HCO3)2溶液与少量NaOH溶液反应: 2HCO3-+Ca2++2OH-=CaCO3↓+2H2O + CO32-B.Na2O2溶于水产生O2












