为除去粗盐中的Ca2+ Mg2+ SO 2-4以及泥沙等杂质 某同学设计了一种制备精盐的实验方案 步
为除去粗盐中的Ca2+、Mg2+、SO
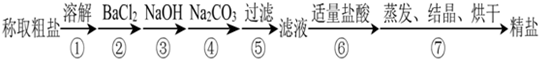 (1)在第①步和第⑤步中都需要用到玻璃棒,其作用分别是______、______. (2)判断BaCl2已过量的方法是______. (3)第④步中,相关的离子方程式是______. (4)若先用盐酸再过滤,将对实验结果产生影响,其原因是______. |
参考解答
| (1)在第①步和第⑤步中都需要用到玻璃棒,①步是用玻璃棒搅拌加快固体溶解;⑤是过滤操作,在过滤中玻璃棒起到引流作用,故答案为:搅拌,加快溶解;引流; (2)加入过量氯化钡溶液除去硫酸根离子,检验硫酸根离子已除尽,可静止片刻在上层清液处,滴加一滴氯化钡溶液,不出现浑浊就说明硫酸根离子已经除尽,BaCl2溶液已过量, 故答案为:取少量②中上层清液于试管中,向其中滴加BaCl2溶液,若无沉淀产生,则BaCl2溶液已过量; (3)第④步是利用碳酸钠除去钙离子和过量的钡离子,反应的离子方程式为:Ca2++CO32-=CaCO3↓,Ba2++CO32-=BaCO3↓;故答案为:Ca2++CO32-=CaCO3↓,Ba2++CO32-=BaCO3↓; (4)若先加适量盐酸再过滤,生成的沉淀如CaCO3、Mg(OH)2、BaCO3会溶解在盐酸中,影响制得精盐的纯度; 故答案:会有部分沉淀如CaCO3、Mg(OH)2、BaCO3溶解,离子重新进入溶液,从而影响制得精盐的纯度. |
相似问题
能正确表示下列化学反应的离子方程式是( )A.金属铝溶于盐酸中:Al+2H+=Al3++H2↑B.
能正确表示下列化学反应的离子方程式是( )A.金属铝溶于盐酸中:Al+2H+=Al3++H2↑B.碳酸镁溶于硝酸中:2H++CO32-=CO2↑+H2OC.在澄清石灰水中通入
下列表示对应化学反应的离子方程式不正确的是( )A.FeCl3溶液与Cu的反应:Cu+2Fe3+=
下列表示对应化学反应的离子方程式不正确的是( )A.FeCl3溶液与Cu的反应:Cu+2Fe3+=Cu2++2Fe2+B.NO2与水的反应:3NO2+H2O=2NO3-+NO+2H+C.醋酸溶液
H2S的水溶液不易导电 写出2FeCl3+H2S=2FeCl2+S↓+2HCl的离子方程式是____
H2S的水溶液不易导电,写出2FeCl3+H2S=2FeCl2+S↓+2HCl的离子方程式是______;Na2CO3的电离方程式是:______.
写出下列反应的化学方程式和离子方程式:(1)铁与硫酸铜溶液反应化学方程式:______;离子方程式:
写出下列反应的化学方程式和离子方程式:(1)铁与硫酸铜溶液反应化学方程式:______;离子方程式:______.(2)钠与水的反应化学方程式:______;(3)
下列离子方程式书写正确的是 [ ]A.AgCl沉淀在氨水中溶解:AgCl+2NH3·H2O=
下列离子方程式书写正确的是 [ ]A.AgCl沉淀在氨水中溶解:AgCl+2NH3·H2O==Ag(NH3)2++Cl-+2H2OB.向Na2SO3、NaI的混合溶液中滴加少量氯水:2I-+Cl2==2












