某化学兴趣小组在探究卤素单质的氧化性的实验中发现 在足量的氯化亚铁溶液中 加入1~2滴溴水 振荡后溶
| 某化学兴趣小组在探究卤素单质的氧化性的实验中发现,在足量的氯化亚铁溶液中,加入1~2滴溴水,振荡后溶液呈黄色,原因是什么?Br2能否氧化Fe2+,Fe3+与Br2谁的氧化性更强? (1)甲同学认为:Br2不能氧化Fe2+,Fe3+的氧化性大于Br2,产生上述现象的原因不是化学反应所致,溶液呈黄色是含 (填化学式,下同)所致。 (2)乙同学认为:Br2将Fe2+氧化为Fe3+,Fe3+的氧化性小于Br2,产生上述现象的原因是化学反应所致,则溶液呈黄色是含 所致。 (3)丙同学为验证乙同学的观点,选择下列试剂,设计出两种方案进行实验,并通过观察实验现象,证明了乙同学的观点是正确的,供选用的试剂:a.酚酞试剂;b.CCl4;c.无水酒精;d.KSCN溶液。请你在下表中写出丙同学选用的试剂及实验中观察到的现象。(试剂填序号)
(4)氧化性:Br2>Fe3+,故在FeCl2中滴入1~2滴溴水,溶液呈黄色。发生反应的离子方程式是 。 (5)根据上述实验推测,若在稀溴化亚铁溶液中通入氯气,首先被氧化的离子是 。在100 mL FeBr2溶液中通入2.24 L Cl2(标准状况),溶液中有 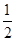 的Br-被氧化成单质Br2,则原FeBr2溶液的物质的量浓度是 。 的Br-被氧化成单质Br2,则原FeBr2溶液的物质的量浓度是 。 |
参考解答
(1)Br2 (2)Fe3+ (3)见下表:
(4)2Fe2++Br2=2Fe3++2Br- (5)Fe2+;1 mol·L-1 |
| (1)(2)若氧化性Fe3+>Br2,则溶液呈黄色是Br2所致,相反,则必为Fe3+所致。(3)若证明溶液呈黄色是Fe3+所致,①可加CCl4振荡静置,CCl4层若为无色,可证明乙正确,②可向其中加KSCN溶液,若出现红色溶液,则也可证明乙正确。(4)因氧化性Br2>Fe3+,故加入溴水,可发生2Fe2++Br2=2Fe3++2Br-。(5)中反应的离子方程式为:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl-,则n(FeBr2)=0.1 mol,c(FeBr2)=1 mol·L-1。 |
相似问题
已知反应式:①H2S+I2=S↓+2H++2I- ②H2SO3+2H2S=3S↓+3H2O ③2
已知反应式:①H2S+I2=S↓+2H++2I-②H2SO3+2H2S=3S↓+3H2O③2I-+Br2=I2+2Br- ④H2SO3+I2+H2O=SO42-+2I-+4H+,下列各组中还原性由强到的是A.H2S、H2
2011年3月18日至19日 受“吃碘盐能防止核辐射”等谣言的影响 我国部分地区出现抢购食盐现象。已
2011年3月18日至19日,受“吃碘盐能防止核辐射”等谣言的影响,我国部分地区出现抢购食盐现象。已知碘盐的主要成分是KIO3和NaCl,KIO3与NaHSO3发生反应:
某反应体系中的物质有NaOH Au2O3 Na2S4O6 Au2O H2O Na2S2O3。Au2O
某反应体系中的物质有NaOH、Au2O3,Na2S4O6,Au2O,H2O,Na2S2O3。Au2O3为反应物,则下列有关说法正确的是 [ ]A.该反应体系中有三种元素的价态发生了
下列过程中涉及氧化还原反应的是 [ ]A.氯气通入水中制氯水 B.四氯化碳萃取碘水中的碘 C
下列过程中涉及氧化还原反应的是 [ ]A.氯气通入水中制氯水 B.四氯化碳萃取碘水中的碘 C.过滤除去粗盐中的不溶性杂质 D.蒸馏法将海水淡化为饮用水
高铁酸钾(K2FeO4)和二氧化氯(ClO2)都是高效水处理剂 其工业制备的反应原理分别为 2Fe(
高铁酸钾(K2FeO4)和二氧化氯(ClO2)都是高效水处理剂,其工业制备的反应原理分别为 2Fe(OH)3+3KClO+4KOH=2K2FeO4+3KCl+5H2O 2KClO3+Na2SO3+H2SO4=2












