(12分)(1)太阳能热水器中常使用一种以镍或镍合金空心球为吸收剂的太阳能吸热涂层 写出基态镍原子
| (12分) (1)太阳能热水器中常使用一种以镍或镍合金空心球为吸收剂的太阳能吸热涂层,写出基态镍原子的核外电子排布式 。 (2)富勒烯衍生物由于具有良好的光电性能。富勒烯(C60)的结构如图1,分子中碳原子轨道的杂化类型为 ;1 mol C60分子中σ键的数目为 。科学家把C60和K掺杂在一起制造出的化合物具有超导性能,其晶胞如图2所示。该化合物中的K原子和C60分子的个数比为 。 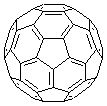  图1  图2 图2 (3)砷化镓是人工合成的新型半导体材料,其晶体结构与金刚石相似。 ①GaAs晶体中,每个As与 个Ga相连。 ②第一电离能:As Se(填“>”、“<”或“=”)。 (4)Na3AsO4可作杀虫剂。AsO43-的空间构型为 ,与其互为等电子体的一种分子为 。 |
参考解答
| (12分) (1)[Ar3d84s2(2分) (2)sp2 (2分) 90mol(2分) 3:1(2分) (3)①4 (1分) ②>(1分) (4)正四面体形(1分) CCl4(1分)(或其他合理答案) |
试题分析:(1)Ni为28号元素,基态原子的核外电子排布式为:[Ar3d84s2 (2)根据富勒烯的结构图可知C原子形成了2个碳碳单键和1个碳碳双键,即3个σ键,所以C原子杂化方式为sp2 ;1个C原子形成3个σ键,每个σ键被两个C原子共用,所以1 mol C60分子中σ键的数目为:3×1/2×60mol=90mol;K位于面上,则1个晶胞含K:12×1/2=6,C60位于8个顶点和1个面心上,则1个晶胞含C60:8×1/8+1=2,所以该化合物中的K原子和C60分子的个数比为3:1。 (3)①砷化镓晶体结构与金刚石相似,空间网状结构,每个原子形成4个单键,与周围的原子形成正四面体,所以每个As与4个Ga相连。 ②AS为第四周期VA族,4p轨道排布3个电子,为稳定状态,Se为第四周期VIA族元素,所以第一电离能:As > Se。 (4)AsO43-中As原子杂化轨道数=(5+3)÷2=4,所以AsO43-的空间构型为正四面体形;含有的原子数和价电子数相等的物质为等电子体,所以与AsO43-互为等电子体的分子有CCl4等。 |
相似问题
今年是门捷列夫诞辰180周年。下列事实不能用元素周期律解释的只有A.碱性:KOH>NaOHB.相对分
今年是门捷列夫诞辰180周年。下列事实不能用元素周期律解释的只有A.碱性:KOH>NaOHB.相对分子质量:Ar>KC.酸性:HClO4>H2SO4D.元素的金属性:Mg>Al
下列说法正确的是;A.用石墨作电极 电解1mol/LNa2CO3的溶液 溶液的pH值保持不变B.非金
下列说法正确的是;A.用石墨作电极,电解1mol LNa2CO3的溶液,溶液的pH值保持不变B.非金属元素呈现的最高化合价不超过该元素的最外层电子数C.含8gNaO
下列各种说法中 正确的是
下列各种说法中,正确的是 ( )A.3号到9号元素化合价的变化与11到17号元素化合价的变化完全相同B.同周期原子半径逐渐减小,所以离子半径也逐渐减
已知34Se和35Br位于同一周期 下列关系正确的是A.原子半径:Br>Se>ClB.热稳定性:HC
已知34Se和35Br位于同一周期,下列关系正确的是A.原子半径:Br>Se>ClB.热稳定性:HCl>H2Se>HBrC.酸性:H2SeO4>HBrO4>HClO4D.还原性:Se2—>Br—>Cl—
下图是部分短周期元素原子(用字母表示)最外层电子数与原子序数的关系图。下列说法正确的是A.该图体现出
下图是部分短周期元素原子(用字母表示)最外层电子数与原子序数的关系图。下列说法正确的是A.该图体现出原子核外电子层呈现周期性变化B.原子半径:W>












