碳 氮 氧 氟都是位于第二周期的重要的非金属元素。请回答下列问题:(1)基态氟原子的核外电子排布式是
| 碳、氮、氧、氟都是位于第二周期的重要的非金属元素。请回答下列问题: (1)基态氟原子的核外电子排布式是______________ 。 (2)C、N、O、F四种元素第一电离能从大到小的顺序是_________________。 (3)碳和另外三种元素均可形成化合物。四氟化碳的空间构型为____________,CF4可以利用甲烷与Cl2和HF在一定条件下反应来制备,其反应方程式为___________;CO是__________分子(填“极性”或“非极性”),CO的常见等电子体为N2、CN-,已知CN-与N2结构相似,推算HCN分子中σ键与π键数目之比为___________;C3N4是一种新型材料,它的硬度比金刚石还高,可做切割工具,可推测出C3N4属于_________晶体。 (4)N4分子结构和白磷一样都是正四面体。又已知断裂1molN-N键吸收167kJ热量,生成1 molN≡N键放出942kJ热量,0.1 molN4转变为N2将放出____________热量: (5)CaF2和CaC2都属于离子晶体。CaF2晶体的密度为a g·cm-3,则晶胞(如图)的体积是_______________(只要求列出算式)。 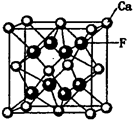 (6)CaC2晶体的晶胞与氯化钠相似,但由于CaC2晶体中的C 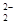 存在,使晶胞沿一个方向拉长,则CaC2晶体中1个C 存在,使晶胞沿一个方向拉长,则CaC2晶体中1个C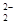 周围距离最近且相等的Ca2+数目为__________,C 周围距离最近且相等的Ca2+数目为__________,C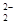 与O 与O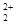 互为等电子体,O 互为等电子体,O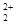 的电子式为____________。 的电子式为____________。 |
参考解答
| (1)1s22s22p5 (1分) (2)F>N>O>C (2分) (3)正四面体(1分) CH4 + 4 Cl2 + 4 HF  CF4 + 8 HCl(2分)。 CF4 + 8 HCl(2分)。极性(1分) 1:1(或2:2)(1分)原子(1分) (4) 88.2 kJ(2分) (5) 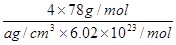 (2分) (2分)(6) 4 (1分) 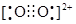 (1分) (1分) |
试题分析:(1)氟是9号元素,基态原子的核外电子排布式是1s22s22p5; (2) 第一电离能N因2p轨道电子半充满稳定而比O大,故 F>N>O>C; (3) 四氟化碳的空间构型为正四面体,制备反应是 CH4 + 4 Cl2 + 4 HF  CF4 + 8 HCl;CO不对称,是极性分子;由N2确定HCN分子的结构式是H—C≡N,分子中σ键与π键数目之比为2:2=1:1;C3N4的硬度比金刚石还高,说明是原子晶体。 CF4 + 8 HCl;CO不对称,是极性分子;由N2确定HCN分子的结构式是H—C≡N,分子中σ键与π键数目之比为2:2=1:1;C3N4的硬度比金刚石还高,说明是原子晶体。(4) N4分子结构和白磷一样都是正四面体,说明有6个N-N。由N4='2' N2可知,0.1 molN4转变为N2将放出热量为0.1×(6×167-2×942)=' 88.2' (kJ)。 (5)晶胞中的Ca2+是4个,F-是8个,由密度为a g·cm-3= 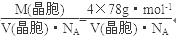 得CaF2晶胞的体积: 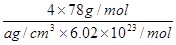 。 。(6)CaC2晶体的晶胞与氯化钠相似,Cl-的周围距离最近有6个Na+,由于CaC2晶体中的C 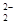 存在,使晶胞沿一个方向拉长,使2Ca2+拉远了,实验CaC2晶体中1个C 存在,使晶胞沿一个方向拉长,使2Ca2+拉远了,实验CaC2晶体中1个C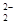 周围距离最近且相等的Ca2+数目为4,C 周围距离最近且相等的Ca2+数目为4,C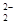 与N2等电子体,故O 与N2等电子体,故O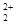 与N2等电子体,电子式是 与N2等电子体,电子式是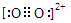 。 。 |
相似问题
下列说法正确的是( )A.原子最外层电子数大于3(小于8)的元素一定是非金属元素B.原子最外层只有
下列说法正确的是()A.原子最外层电子数大于3(小于8)的元素一定是非金属元素B.原子最外层只有1个电子的元素一定是金属元素C.最外层电子数比次外层电
位于同一周期的三种短周期元素X Y Z 它们的最高价氧化物分别为酸性氧化物 碱性氧化物和两性氧化物
位于同一周期的三种短周期元素X、Y、Z,它们的最高价氧化物分别为酸性氧化物、碱性氧化物和两性氧化物,则三种元素的原子序数的大小顺序是A.X>Y>ZB.Y>Z
周期表中前20号元素X Y Z。已知:X+和Y-两种离子具有相同的电子层结构;Z元素原子核·内质子数
周期表中前20号元素X、Y、Z。已知:X+和Y-两种离子具有相同的电子层结构;Z元素原子核·内质子数比Y元素原子核内质子数少9个,Y和Z两元素可以形成含有42
下表是元素周期表的一部分。表中所列的字母分别代表某一化学元素。试回答下列问题(1)元素“O”在周期表
下表是元素周期表的一部分。表中所列的字母分别代表某一化学元素。试回答下列问题(1)元素“O”在周期表中的位置是。(2)画出“c”的简化电子排布式。
已知X元素的阳离子和Y元素的阴离子具有与氩原子相同的电子层结构 则下列叙述正确的是A.X的原子序数比
已知X元素的阳离子和Y元素的阴离子具有与氩原子相同的电子层结构,则下列叙述正确的是A.X的原子序数比Y的小B.X原子的最外层电子数比Y的大 C.X的原子












