(13分)有A B C D E R六种短周期元素 其元素特征信息如下表: 元素编号元素特征信息A其单
(13分)有A、B、C、D、E、R六种短周期元素,其元素特征信息如下表:
(1)写出下列元素的名称:C ,E ;画出B的阴离子结构示意图: 。 (2)B、C、D的简单离子半径由大到小的顺序是 (用化学式表示)。E元素的最高价含氧酸的化学式是 ; (3)实验证明D的氢氧化物(或氧化物)具有两性的操作方法是: 。 (4)在一定条件下,RO32-与R2-可发生反应:RO32-+2R2-+6H+ = 3R+3H2O,下列有关叙述中,正确的是 (填序号)。 A.元素R位于周期表中第3 周期,ⅥA族 B.R2-与氖原子电子层结构相同 C.RO32-在它能发生的所有反应中都只具有氧化性 D.反应中消耗1 mol RO32- ,转移的电子的物质的量为4 mol (5)请写出涉及上述元素间的两个反应的离子方程式,要求:(1)单质之间的置换 (2)在方程式中如为两种非金属则必须是不同主族的。 ; 。 |
参考解答
(1)镁 氯 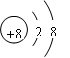 (2) O2->Mg2+>Al3+ ;HClO4 (2) O2->Mg2+>Al3+ ;HClO4(3)向其氢氧化物(或氧化物)中分别加入足量NaOH溶液、盐酸,固体都能够溶解。 (4)AD ; (5)Mg+2H+=Mg2++H2↑(或2Al+6H+=2 Al3++3H2↑;或3Mg+2Al3+=3Mg2++2Al) Cl2+S2-=S↓+2Cl-(或Cl2+H2S=S↓+2Cl-+2H+) |
试题分析:根据题意可推知这几种元素分别是:A是H;B是O;C是Mg;D是Al; E是Cl;R是S。(1)C元素的名称是镁;E元素的名称为氯;(2)O、Mg、Al的离子的电子层结构相同,都是2、8的排布。对于电子层结构相同的微粒来说,离子的核电荷数越大,离子的半径就越小。所以简单离子半径由大到小的顺序是O2->Mg2+>Al3+;Cl元素的原子最外层有7个电子,最高化合价为+7价,所以其最高价含氧酸的化学式是HClO4。(3)证明Al(OH)3具有两性的操作方法是向Al(OH)3中分别加入足量NaOH溶液、盐酸,固体都能够溶解。就可证明。(4)A. S的核外电子排布是2、8、6,因此元素R位于周期表中第3 周期,ⅥA族。正确。B.S2-与Ar原子电子层结构相同。错误。C.SO32-在有的反应中具有氧化性,在有的反应中表现还原性。错误。D.根据氧化还原反应中的电子转移数目相等可知在反应RO32-+2R2-+6H+ = 3R+3H2O中,每消耗1 mol RO32- ,转移的电子的物质的量为4 mol。正确。(5)符合题意的两个反应的离子方程式是Mg+2H+=Mg2++H2↑;Cl2+S2-=S↓+2Cl-等。 |
相似问题
X Y Z W为四种短周期元素 它们在周期表中的位置如图所示。Z元素原子核外第一层与第三层电子数相等
X、Y、Z、W为四种短周期元素,它们在周期表中的位置如图所示。Z元素原子核外第一层与第三层电子数相等。下列说法不正确的是A.与相同浓度的盐酸反应,Z单
下列描述中正确的是 ( )A.CS2为V形分子B.NCl3的空间构型为平面三角形C.铝的第
下列描述中正确的是 ()A.CS2为V形分子B.NCl3的空间构型为平面三角形C.铝的第一电离能比镁的第一电离能大D.SiF4和H2O的中心原子均为sp3杂化
下列有关说法正确的是( )A.在多电子的原子里 能量高的电子通常在离核近的区域内运动B.最外层电
下列有关说法正确的是()A.在多电子的原子里,能量高的电子通常在离核近的区域内运动B.最外层电子数为8的微粒均是稀有气体元素的原子C.俄国化学家道
A B C D E F为原子序数依次增大的六种元素 其中A B C D E为短周期主族元素。常温下A
A、B、C、D、E、F为原子序数依次增大的六种元素,其中A、B、C、D、E为短周期主族元素。常温下A、B、C的常见单质均为无色、无味的气体,D、E的单质均为固
下列递变规律正确的是:A.HClO4 H2SO4 H3PO4的酸性依次增强B.P S Cl最高正价依
下列递变规律正确的是:A.HClO4、H2SO4、H3PO4的酸性依次增强B.P、S、Cl最高正价依次升高C.HCl、HBr、HI的稳定性依次增强D.锂、钠、钾的金属性依次增强












