(本小题15分)用二氧化氯(ClO2) 铁酸钠(Na2FeO4摩尔质量为166 g·mol-1)等新
| (本小题15分)用二氧化氯(ClO2)、铁酸钠(Na2FeO4摩尔质量为166 g·mol-1)等新型净水剂替代传统的净水剂Cl2对淡水进行消毒是城市饮用水处理新技术。ClO2和Na2FeO4在水处理过程中分别被还原为Cl-和Fe3+。 (1)如果以单位质量的氧化剂所得到的电子数来表示消毒效率,那么,ClO2、Na2FeO4、Cl2三种消毒杀菌剂的消毒效率由大到小的顺序是 > > 。 (2)铁酸钠之所以能净水,除它本身具有强氧化性外,另一个原因可能是: 。 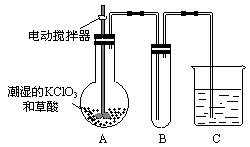 (3)二氧化氯是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水。ClO2可以看做是亚氯酸(HClO2)和氯酸(HClO3)的混合酸酐。工业上用稍潮湿的KClO3和草酸在60℃时反应制得。某学生用如图所示的装置模拟工业制取及收集ClO2,其中A为ClO2的发生装置,B为ClO2的凝集装置,C为尾气吸收装置。请问: ①A部分还应添加温度控制(如水浴加热)装置,B部分还应补充什么装置 ; ②C中应装的试剂为 。C中发生反应的化学方程式为: 。 |
参考解答
| (1)ClO2 Cl2 Na2FeO4(5分) (2)铁酸钠的还原产物Fe3+能水解生成Fe(OH)3胶体,能吸附水中悬浮物,从而净水(3分) (3)①(冰水)冷凝(2分) ②NaOH溶液(2分,其它合理也可) 2ClO2+2NaOH='==' NaClO2+NaClO3+H2O(3分,其它反应不是主要得分点) |
(1)设ClO2、Na2FeO4、Cl2的质量均为1 g,则被还原时,它们得到电子的物质的量分别为:ClO2: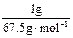 ×5=0.074 mol;Na2FeO4: ×5=0.074 mol;Na2FeO4: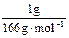 ×3=0.018 mol;Cl2: ×3=0.018 mol;Cl2: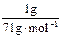 ×2=0.028 mol。故三种物质的消毒效率由大到小的顺序是ClO2>Cl2>Na2FeO4。 ×2=0.028 mol。故三种物质的消毒效率由大到小的顺序是ClO2>Cl2>Na2FeO4。(2)铁酸钠在消毒时,被还原为Fe3+,Fe3++3H2O  Fe(OH)3+3H+,水解生成的Fe(OH)3胶体表面积较大,具有吸附性能,可吸附水中悬浮的杂质。 Fe(OH)3+3H+,水解生成的Fe(OH)3胶体表面积较大,具有吸附性能,可吸附水中悬浮的杂质。(3)由题所给信息,二氧化氯的物理性质可知,二氧化氯被收集在B装置中,为提高收集效果,应补加冷凝装置。ClO2可以看做是亚氯酸(HClO2)和氯酸(HClO3)的混合酸酐,所以尾气可用NaOH溶液吸收,发生歧化反应,生成NaClO2和NaClO3混合盐。技能空间:自身氧化还原反应中的“歧化”与“归中”。歧化反应:反应物自身氧化还原反应,同种元素一部分化合价升高,一部分化合价降低的反应。如Cl2 +2NaOH='==NaCl' +NaClO+H2O。归中反应:同一元素不同价态原子间发生氧化还原反应时:高价态降低为中间价态, 低价态升高为中间价态,也可归纳为:两相靠,不相交。若中间有多种价态,则原高价物质对应的还原产物价态仍高,原低价态的物质对应的氧化产物的价态仍低。如H2SO4(浓)+H2S===S↓+2SO2↑+2H2O,此反应中H2S不可能变为SO2,同样,H2SO4也不可能变为生成物中S。 应试策略:化学实验与化学计算放在一起进行综合考查是高考命题的趋势之一,考试大纲也提出明确要求:根据实验现象,观察、记录、分析或处理数据,得出正确结论。我们在复习化学实验知识的同时,绝对不能忽视对元素化合物、基本概念、理论、化学计算等方面知识的复习,高考化学考查的内容充分体现了学科内知识的系统性和综合性。 |
相似问题
为验证卤素单质氧化性的相对强弱 某小组用右图所示装置进行试验(夹持仪器已略去 气密性已检验)。试验过
为验证卤素单质氧化性的相对强弱,某小组用右图所示装置进行试验(夹持仪器已略去,气密性已检验)。试验过程:I.打开弹簧夹,打开活塞a,滴加浓盐酸。II
下列事实可体现某些卤素或卤化物特有的性质的是()A.氟化氢可用于雕刻玻璃B.溴化银在光的照射下即可分
下列事实可体现某些卤素或卤化物特有的性质的是()A.氟化氢可用于雕刻玻璃B.溴化银在光的照射下即可分解C.单质溴在水和汽油中的溶解性不同D.碘能使
美国宇航局(NASA)马丽诺娃博士最近找到了一种比二氧化碳有效10 000倍的“超级温室气体”——全
美国宇航局(NASA)马丽诺娃博士最近找到了一种比二氧化碳有效10 000倍的“超级温室气体”——全氟丙烷,并提出用其“温室化火星”,使火星成为第二个地
下列物质能使有色布条褪色的是( )A.干燥的氯气B.潮湿的氯气C.干燥的次氯酸钙D.氯化钙
下列物质能使有色布条褪色的是( )A.干燥的氯气B.潮湿的氯气C.干燥的次氯酸钙D.氯化钙
实验室常用盐酸的质量分数为36.5% 密度为1.20g/㎝3。⑴此浓盐酸的物质的量浓度是多少?(列式
实验室常用盐酸的质量分数为36 5%,密度为1 20g ㎝3。⑴此浓盐酸的物质的量浓度是多少?(列式计算)⑵配制100mL3 00mol L的盐酸,需以上浓盐酸多少mL?(列式计算)












