某研究性学习小组通过下列实验探究SO2能否与BaCl2溶液反应生成BaSO3沉淀 并制备硫酸铜晶体。
某研究性学习小组通过下列实验探究SO2能否与BaCl2溶液反应生成BaSO3沉淀,并制备硫酸铜晶体。完成下列填空。甲同学用装置I进行实验,加热反应物至沸腾,发现BaCl2溶液中出现白色沉淀,且白色沉淀不溶于盐酸。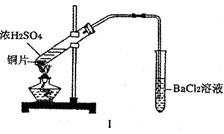 (1)白色沉淀是 。 (2)甲同学就白色沉淀的生成原因提出了两种假设,这两种假设可能是: ① ② 乙同学设计了改进装置Ⅱ进行实验,检验甲同学提出的假设(夹持装置和A中加热装置已略,气密性已检验)。 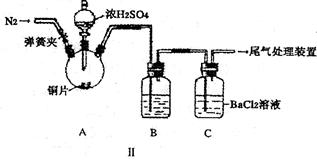 ①打开弹簧夹,通入N2一段时间后关闭弹簧夹; ②滴加一定量浓硫酸,加热A,一段时间后C中未见沉淀生成。 (3)操作①的目的是 ,集气瓶B中的试剂是 。 (4)该实验能否检验甲同学上述两种假设中的任意一种 ,理由是 。 丙同学向反应后的蓝色溶液中加入足量的CuO,过滤后将滤液制成硫酸铜晶体(CuSO4·xH2O),采用加热法测定该晶体中结晶水x的值,实验数据记录如下:
(5)若无需再进行第三次称量,则a的数值范围应为 。 (6)若加热后坩埚与固体总质量为18.620g,计算x 的实测值 (保留二位小数),相对误差 。 | ||||||||||
参考解答
| (1)BaSO4(2分); (2)①浓硫酸沸腾蒸出进入氯化钡溶液生成沉淀(1分) ②SO2被氧气氧化成硫酸生成沉淀(1分) (3)排除装置内的空气(O2)(1分) 饱和NaHSO3溶液(1分) (4)不能(1分),因为同时改变了两个变量,无法确定到底是哪个变量的作用。(1分) (5)18.621±0.001 (1分) (6)5.25 (2分) +5%(1分) |
试题分析:(1)白色沉淀不溶于盐酸,因此白色沉淀是硫酸钡。 (2)根据硫酸的沸点和加热温度分析,说明浓硫酸在温度较高时也能挥发出H2SO4蒸气,由于BaSO3能够溶于盐酸,根据元素守恒可知该沉淀只能是BaSO4,有可能一是挥发出的H2SO4提供的SO42-与Ba2+反应生成的,也有可能是溶液中溶解的氧气与SO2作用产生了硫酸,进而得到BaSO4; (3)氮气性质稳定,排净装置中的空气中的氧气,以验证上述原理是否正确;为除去反应中带出的雾状硫酸,可以将气体通过饱和NaHSO3溶液; (4)由于同时改变了两个变量,无法确定到底是哪个变量的作用。 (5)由于两次实验误差不能超过0.001,所以若无需再进行第三次称量,则a的数值范围应为18.621±0.001。 (6)若加热后坩埚与固体总质量为18.620g,因此失去的结晶水质量为22.700g -18.620g=4.08g,水的物质的量是0.227mol。晶体的质量为22.700g-11.710g=10.99g,则 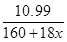 ×x=0.227 ×x=0.227解得x=5.25,因此相对误差为 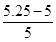 ×100%=5%。 ×100%=5%。 |
相似问题
“飘尘”是物质燃烧时产生的粒状漂浮物 颗粒很小(直径小于10-7 m) 不易沉降(可漂浮数小时甚至数
“飘尘”是物质燃烧时产生的粒状漂浮物,颗粒很小(直径小于10-7 m),不易沉降(可漂浮数小时甚至数年),它与空气中的SO2、O2接触时,SO2会转化为SO3,使
下列说法正确的是 [ ]A.铜的熔点比青铜的熔点高 B.燃烧一定要有氧气参加 C.硅在自然界
下列说法正确的是 [ ]A.铜的熔点比青铜的熔点高 B.燃烧一定要有氧气参加 C.硅在自然界中既有游离态又有化合态 D.氯气不能支持燃烧
下列气体中 不能用98.3%的浓硫酸干燥的是[ ](1) SO3 (2)SO2 (3)Cl2
下列气体中,不能用98 3%的浓硫酸干燥的是[ ](1)SO3、(2)SO2、(3)Cl2、(4)H2SA、只有(4) B、(1)和(4)C、(3)和(4) D、(1)(2)(4)
自来水可用氯气消毒 某学生用这种自来水去配制下列物质溶液 不会产生明显的试剂变质问题的是[
自来水可用氯气消毒,某学生用这种自来水去配制下列物质溶液,不会产生明显的试剂变质问题的是[ ]A.AgNO3B.FeCl2 C.Na2SO3D.AlCl3
某溶液中含有HCO3- SO32- SO42- Cl-和Na+ 若向其中通入Cl2后溶液中离子浓度增
某溶液中含有HCO3-、SO32-、SO42-、Cl-和Na+,若向其中通入Cl2后溶液中离子浓度增大的是 [ ]A.HCO3-B.SO42- C.SO32-D.Na+












