化合物Li+[Co3(CO)10]-在2 080~2 000 cm-1 1 850 cm-1和1 6
化合物Li+[Co3(CO)10]-在2 080~2 000 cm-1、1 850 cm-1和1 600 cm-1区出现三个不同类型的羰基带,试推断该阴离子的合理结构。
请帮忙给出正确答案和分析,谢谢!
参考解答
正确答案:在金属羰基化合物中CO有三种方式与金属原子结合:即端基、边桥基和面桥基。自由CO的C一O键伸缩振动的红外吸收峰在2 143 cm-1形成配合物后C一O键振动频率发生变化是因为金属的d电子反馈到CO的π*轨道上去使C一O键的强度降低更多则吸收峰的波数变小。端基CO只接受一个金属原子的d电子进入反键π*轨道C一O键伸缩振动的红外吸收峰降为2 000 cm-1左右;边桥基接受两个金属原子的d电子进入反键π*轨道C—O键伸缩振动的红外吸收峰降为1 850 cm-1左右;而面桥基将接受三个金属原子的d电子进入反键π*轨道C一O键伸缩振动的红外吸收峰更降为1 600 cm-1左右。阴离子[Co3(CO)10-中的CO应具有端基、边桥基和面桥基三种形式的结合。显然三个Co原子应成三角形排布三角形的三条边上各接纳一个边桥基三角形的基面上可以接纳一个面桥基剩余6个CO则每个Co原子各连接2个端基如下图: 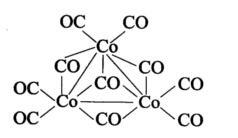
在金属羰基化合物中,CO有三种方式与金属原子结合:即端基、边桥基和面桥基。自由CO的C一O键伸缩振动的红外吸收峰在2143cm-1,形成配合物后,C一O键振动频率发生变化,是因为金属的d电子反馈到CO的π*轨道上去,使C一O键的强度降低更多,则吸收峰的波数变小。端基CO只接受一个金属原子的d电子进入反键π*轨道,C一O键伸缩振动的红外吸收峰降为2000cm-1左右;边桥基接受两个金属原子的d电子进入反键π*轨道,C—O键伸缩振动的红外吸收峰降为1850cm-1左右;而面桥基将接受三个金属原子的d电子进入反键π*轨道,C一O键伸缩振动的红外吸收峰更降为1600cm-1左右。阴离子[Co3(CO)10-中的CO应具有端基、边桥基和面桥基三种形式的结合。显然,三个Co原子应成三角形排布,三角形的三条边上各接纳一个边桥基,三角形的基面上可以接纳一个面桥基,剩余6个CO,则每个Co原子各连接2个端基,如下图:
相似问题
U4++Fe3++H2O→请帮忙给出正确答案和分析 谢谢!
U4++Fe3++H2O→请帮忙给出正确答案和分析,谢谢!
在单质金属中 最软的是________________ 最硬的是________________;熔
在单质金属中,最软的是________________,最硬的是________________;熔点最低的是________________,熔点最高的是________________;密度最小的是_____
在CoCl2溶液中加入适量氨水 生成________________ 再加入过量氨水则生成_____
在CoCl2溶液中加入适量氨水,生成________________,再加入过量氨水则生成________________,在空气中放置后变为________________。请帮忙给出正确答案和分析,谢谢!
正三价轻稀土离子(Ln3+)和二苯基-18-冠-6(C20H24O6)生成的Ln(NO3)3·C20
正三价轻稀土离子(Ln3+)和二苯基-18-冠-6(C20H24O6)生成的Ln(NO3)3·C20H24O6型螯合物中,配位原子是________________________原子,Ln3+周围共有_______
为什么铁 钴 镍的最高氧化态都没有达到各自的3 d和4 s电子数的总和?它们的最高氧化数分别是多少?
为什么铁、钴、镍的最高氧化态都没有达到各自的3 d和4 s电子数的总和?它们的最高氧化数分别是多少?请帮忙给出正确答案和分析,谢谢!












