用标准式蒸发器将含NaOH质量分数16%的水溶液浓缩至45%。加热蒸汽的压力p=250kPa(对应温
用标准式蒸发器将含NaOH质量分数16%的水溶液浓缩至45%。加热蒸汽的压力p=250kPa(对应温度T=127.2℃),冷凝器的绝压为15kPa(对应蒸汽温度为54℃)。试计算如下三种操作方案的有效温度差: (1)单效蒸发; (2)双效并流加料,各效蒸发量相等; (3)三效并流加料,各效蒸发量相等。 原料液的处理量为1000kg/h。忽略液柱静压效应。不同压力下的沸点升高可取常压下数值。
请帮忙给出正确答案和分析,谢谢!
参考解答
正确答案:有效温度差为△tm=△tT-∑△由于忽略加热管内液柱静压力引起的沸点升高则∑△=∑△'+∑△''本题的关键是确定不同组成下饱和蒸气压下降引起的沸点升高△'取效之间△''=1℃末效与冷凝器之间△''=1.5℃。水分的总蒸发量为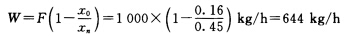 (1)单效蒸发蒸发器溶液的组成为x=0.45此组成溶液的沸点升高为△'=(135.4-100)℃=35.4℃△tT=(127.4-54)℃=73.4℃∑△=(35.4+1.5)℃=36.9℃则Atm=(73.4-35.4-1.5)℃=36.5℃(2)两效并流蒸发总温度差损失为两效之和。第二效以完成液组成为准求算的温度差损失同单效数值即∑△2=36.9℃而第一效温差损失以第一效完成液组成来确定。
(1)单效蒸发蒸发器溶液的组成为x=0.45此组成溶液的沸点升高为△'=(135.4-100)℃=35.4℃△tT=(127.4-54)℃=73.4℃∑△=(35.4+1.5)℃=36.9℃则Atm=(73.4-35.4-1.5)℃=36.5℃(2)两效并流蒸发总温度差损失为两效之和。第二效以完成液组成为准求算的温度差损失同单效数值即∑△2=36.9℃而第一效温差损失以第一效完成液组成来确定。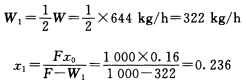 常压下0.236的NaOH水溶液△a'=11.7℃∑△=(11.7+1.0)℃=12.7℃∑△=∑△1+∑△2=(12.7+36.9)℃=49.6℃则Atm=△tT-∑△=(73.4-49.6)℃=23.8℃(3)三效并流加热蒸发第三效的温差损失仍为36.9℃第一、二效温差损失以其对应溶液组成来确定。由物料衡算可求得各效溶液组成并确定其沸点升高为第一效x1=0.2037 ∑△1=(7.3+1.0)℃=8.3℃第二效x2=0.2804 ∑△2=(16.2+1.0)℃=17.2℃∑△=(36.9+8.3+17.2)℃=62.4℃Atm=(73.4-62.4)℃=11.0℃。
常压下0.236的NaOH水溶液△a'=11.7℃∑△=(11.7+1.0)℃=12.7℃∑△=∑△1+∑△2=(12.7+36.9)℃=49.6℃则Atm=△tT-∑△=(73.4-49.6)℃=23.8℃(3)三效并流加热蒸发第三效的温差损失仍为36.9℃第一、二效温差损失以其对应溶液组成来确定。由物料衡算可求得各效溶液组成并确定其沸点升高为第一效x1=0.2037 ∑△1=(7.3+1.0)℃=8.3℃第二效x2=0.2804 ∑△2=(16.2+1.0)℃=17.2℃∑△=(36.9+8.3+17.2)℃=62.4℃Atm=(73.4-62.4)℃=11.0℃。
通过本题计算数据看出,当溶质存在引起的沸点升高比较明显时,多效蒸发的总温度差损失随效数增加而加大,总有效温度差则相应降低。对本题来说,三效蒸发△tm只有11℃,分配到各效不足4℃。若再考虑液柱静压力引起的沸点升高,将可能没有传热推动力,导致操作达不到预期效果,甚至不能进行操作。对于沸点升高显著的溶液的多效蒸发,效数有个最佳选择问题。
相似问题
填料塔的正常操作区域为( )。A.载液区B.液泛区;C.恒持液量区;D.任何区域请帮忙给出正确答案和
填料塔的正常操作区域为( )。A.载液区B.液泛区;C.恒持液量区;D.任何区域请帮忙给出正确答案和分析,谢谢!
平衡分离与速率分离各有哪些主要类型 它们的区别是什么?请帮忙给出正确答案和分析 谢谢!
平衡分离与速率分离各有哪些主要类型,它们的区别是什么?请帮忙给出正确答案和分析,谢谢!
气体中的扩散系数DAB与温度T的关系为( )。A.DAB∝T1.0;B.DAB∝T0.5;C.DAB
气体中的扩散系数DAB与温度T的关系为( )。A.DAB∝T1.0;B.DAB∝T0.5;C.DAB∝T2.0;D.DAB∝T1.75请帮忙给出正确答案和分析,谢谢!
在进行分子传质时 总体流动是如何形成的 总体流动对分子传质通量有何影响?请帮忙给出正确答案和分析 谢
在进行分子传质时,总体流动是如何形成的,总体流动对分子传质通量有何影响?请帮忙给出正确答案和分析,谢谢!
和一般的传热过程相比较 蒸发操作有何特点?请帮忙给出正确答案和分析 谢谢!
和一般的传热过程相比较,蒸发操作有何特点?请帮忙给出正确答案和分析,谢谢!












