参考解答
正确答案:由杂化轨道的归一性可知等性的sp2杂化轨道波函数一般形式应为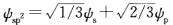 为了计算方便令∮的方向与Pχ原子轨道的方向一致所以只有Pχ对∮1有贡献Py没有贡献
为了计算方便令∮的方向与Pχ原子轨道的方向一致所以只有Pχ对∮1有贡献Py没有贡献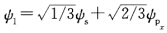 ∮2和∮3中两个p轨道都有贡献其组合系数分别为b2、b3、c2、c3
∮2和∮3中两个p轨道都有贡献其组合系数分别为b2、b3、c2、c3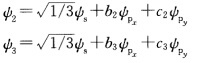 由归一化条件知
由归一化条件知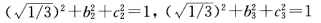 根据杂化轨道正交性质得
根据杂化轨道正交性质得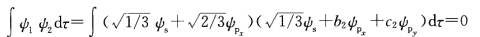 原子轨道具有正交归一性所以上式得
原子轨道具有正交归一性所以上式得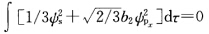 即1/3+
即1/3+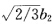 =0。同样∮1与∮3正交即1/3
=0。同样∮1与∮3正交即1/3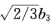 =0得b2=3=-1/
=0得b2=3=-1/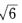 即Pχ轨道对∮2、∮3的贡献是一样的。 再根据杂化轨道归一性可知∮2、∮3中有
即Pχ轨道对∮2、∮3的贡献是一样的。 再根据杂化轨道归一性可知∮2、∮3中有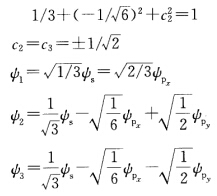
由杂化轨道的归一性可知,等性的sp2杂化轨道波函数一般形式应为为了计算方便,令∮的方向与Pχ原子轨道的方向一致,所以只有Pχ对∮1有贡献,Py没有贡献∮2和∮3中两个p轨道都有贡献,其组合系数分别为b2、b3、c2、c3由归一化条件知根据杂化轨道正交性质得原子轨道具有正交归一性,所以上式得即1/3+=0。同样∮1与∮3正交,即1/3=0,得b2=3=-1/即Pχ轨道对∮2、∮3的贡献是一样的。再根据杂化轨道归一性可知,∮2、∮3中有
相似问题
已知一类氢离子的波函数∮n l m 共有两个节面 一个是球面 另一个是χy面 这个波函数的n l m
已知一类氢离子的波函数∮n,l,m,共有两个节面,一个是球面,另一个是χy面,这个波函数的n、l、m分别是多少?请帮忙给出正确答案和分析,谢谢!
下列分子具有偶极矩 而不属于Cnv群的是( )。A.H2O2B.NH3C.CH2Cl2D.H2CCH
下列分子具有偶极矩,而不属于Cnv群的是( )。A.H2O2B.NH3C.CH2Cl2D.H2CCH2请帮忙给出正确答案和分析,谢谢!
按环丁二烯是平面正方形构型 用HMO法求其π电子能级及离域能。请帮忙给出正确答案和分析 谢谢!
按环丁二烯是平面正方形构型,用HMO法求其π电子能级及离域能。请帮忙给出正确答案和分析,谢谢!
原子轨道是原子中的单电子波函数 每个原子轨道只能容纳_______个电子。请帮忙给出正确答案和分析
原子轨道是原子中的单电子波函数,每个原子轨道只能容纳_______个电子。请帮忙给出正确答案和分析,谢谢!
关于原子轨道能量的大小 下列叙述正确的是( )。A.电子按轨道能大小顺序排入原子B.原子轨道能的高低
关于原子轨道能量的大小,下列叙述正确的是( )。A.电子按轨道能大小顺序排入原子B.原子轨道能的高低可用(n+0.7l)判断C.同种轨道的能量值是一个恒定












