日常饮用水中NO3一的含量是水质卫生检验的重要标准之一 达到一定浓度时会对人类健康产生危害 为了降低
日常饮用水中NO3一的含量是水质卫生检验的重要标准之一,达到一定浓度时会对人类健康产生危害,为了降低饮用水中NO3一的浓度,某兴趣小组提出如下方案: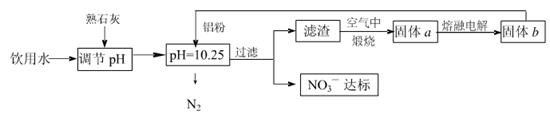 请回答下列问题: (1)该方案在调节pH时,若pH过大或过小都会造成 的利用率降低。 (2)已知过滤后得到的滤液中几乎不含铝元素。①在溶液中铝粉和NO3一反应的离子方程式为 。 ②滤渣在空气中煅烧过程中涉及的相关反应方程式为 (3)用H2催化还原法也可降低饮用水中NO3—的浓度,已知反应中的还原产物和氧化产物均可参与大气循环,则催化还原法的离子方程式为 。 (4)饮用水中的NO3- 主要来自于NH4+。已知在微生物作用下,NH4+ 经过两步反应被氧化成NO3- 。两步反应的能量变化示意图如下: 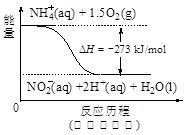 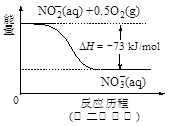 试写出1 mol NH4+ (aq)全部氧化成NO3- (aq)的热化学方程式是 。 (5)固体a熔融电解时阴极反应式为 |
参考解答
| (1)铝(或Al)(2分) (2)①10Al+6NO3—+18H2O=10Al(OH)3↓+3N2↑+6OH—(2分) ②4Al+ 3O2  2 Al2 O3 2Al(OH)3 2 Al2 O3 2Al(OH)3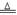 Al2 O3+3 H2O(各2分) Al2 O3+3 H2O(各2分)(3)5H2+2NO3— 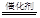 N2↑+4H2O+2OH— (2分) N2↑+4H2O+2OH— (2分)(或5H2+2NO3—+2H+ 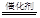 N2↑+6H2O) N2↑+6H2O)(4)NH4+ (aq)+2O2(g)=2H+(aq)+NO3- (aq)+H2O(l) △H=-346 kJ·mol-1(2分) (5)Al3++3e-= Al(2分) |
试题分析:(1)由于铝能和酸或碱都能反应,该方案在调节pH时,若pH过大或过小都会造成铝(或Al) 的利用率降低。(2)①铝粉与硝酸根离子发生氧化还原反应生成固体,则固体为氢氧化铝,则硝酸被还原为氮气,则在溶液中铝粉和NO3﹣反应的离子方程式为10Al+6NO3﹣+18H2O=10Al(OH)3+3N2↑+6OH﹣;②滤渣在空气中煅烧过程中涉及的相关反应方程式为4Al+ 3O2 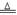 2 Al2 O3和2Al(OH)3 2 Al2 O3和2Al(OH)3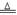 Al2 O3+3 H2O。(3)H2催化还原饮用水中NO3﹣,反应中的还原产物和氧化产物均可参与大气循环,则产物为水和氮气,该反应为5H2+2NO3﹣ Al2 O3+3 H2O。(3)H2催化还原饮用水中NO3﹣,反应中的还原产物和氧化产物均可参与大气循环,则产物为水和氮气,该反应为5H2+2NO3﹣ N2+4H2O+2OH﹣;(4)由图可知,第一步热化学反应为NH4+(aq)+1.5O2(g)=2H+(aq)+NO2﹣ (aq)+H2O(l)△H=﹣2736 kJ?mol﹣1①,第二步热化学反应为NO2﹣ (aq)+0.5O2(g)=NO3﹣ (aq))△H=﹣73kJ?mol﹣1②,由盖斯定律可知①+②得1mol NH4+(aq)全部氧化成NO3﹣ (aq)的热化学方程式为NH4+(aq)+2O2(g)=2H+(aq)+NO3﹣ (aq)+H2O(l)△H=﹣346 kJ?mol﹣1。(5)固体a熔融电解时阴极是提电子的,反应式为Al3++3e-= Al。 N2+4H2O+2OH﹣;(4)由图可知,第一步热化学反应为NH4+(aq)+1.5O2(g)=2H+(aq)+NO2﹣ (aq)+H2O(l)△H=﹣2736 kJ?mol﹣1①,第二步热化学反应为NO2﹣ (aq)+0.5O2(g)=NO3﹣ (aq))△H=﹣73kJ?mol﹣1②,由盖斯定律可知①+②得1mol NH4+(aq)全部氧化成NO3﹣ (aq)的热化学方程式为NH4+(aq)+2O2(g)=2H+(aq)+NO3﹣ (aq)+H2O(l)△H=﹣346 kJ?mol﹣1。(5)固体a熔融电解时阴极是提电子的,反应式为Al3++3e-= Al。 |
相似问题
.现有失去标签的四瓶无色溶液A.B.C.D 只知道它们是K2CO3.K2SO4.H2SO4和Ba(N
现有失去标签的四瓶无色溶液A.B.C.D,只知道它们是K2CO3.K2SO4.H2SO4和Ba(NO3)2,为了鉴别它们,进行如下实验:①A+D―→溶液+气体②B+C―→溶
下列表示对应化学反应的离子方程式正确的是A.工业电解饱和食盐水:2Cl-+H2O=Cl2↑+H2↑+
下列表示对应化学反应的离子方程式正确的是A.工业电解饱和食盐水:2Cl-+H2O=Cl2↑+H2↑+OH-B.碳酸钠的水解:CO32-+2H2OH2CO3+2OH-C.硫酸铝溶液中
下列离子方程式正确的是A.碳酸氢钠与稀盐酸反应:HCO3—+H+=CO2↑+H2OB.铝溶于NaOH
下列离子方程式正确的是A.碳酸氢钠与稀盐酸反应:HCO3—+H+=CO2↑+H2OB.铝溶于NaOH溶液:Al+2OH—=AlO2—+H2↑C.碳酸镁中滴加稀盐酸:CO32—+2H+=CO2
下列离子方程式书写正确的是A.钠与硫酸铜溶液反应:Cu2++2Na=2Na++CuB.铁屑溶于过量稀
下列离子方程式书写正确的是A.钠与硫酸铜溶液反应:Cu2++2Na=2Na++CuB.铁屑溶于过量稀硝酸:3Fe+8H++2NO3-=3Fe2++2NO↑+4H2OC.石灰石溶于
下列反应的离子方程式不正确的是A.NaOH溶液与稀H2SO4反应:H++OH—=H2OB.NaHCO
下列反应的离子方程式不正确的是A.NaOH溶液与稀H2SO4反应:H++OH—=H2OB.NaHCO3与NaOH两溶液反应:HCO3-+OH—=CO32-+H2OC.金属钠与水反应:2Na+












