(14分)Na Cu O Si S Cl是常见的六种元素。(1)Na位于元素周期表第
| (14分)Na、Cu、O、Si、S、Cl是常见的六种元素。 (1)Na位于元素周期表第 周期第 族;S的基态原子核外有 个未成对电子;Si的基态原子核外电子排布式为 。 (2)用“>”或“<”填空:
(3)CuCl(s)与O2反应生成CuCl2(s)和一种黑色固体。在25 ℃、101KPa下,已知该反应每消耗1 mol CuCl2(s),放热44.4KJ,该反应的热化学方程式是 。 (4)ClO2是常用于水的净化,工业上可用Cl2氧化NaClO2溶液制取ClO2。写出该反应的离子方程式,并标出电子转移的方向和数目 。 |
参考解答
(1)第三周期,第ⅠA族 2,1s22s22p63s23p2 (2)<,>,<,<, (3)4CuCl(s)+O2(g)=2CuCl2(2)+2CuO(s) △H=-177.6kJ/mol (4) 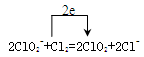 |
试题分析:(1)S的最外层有6个电子,为3s23p4,3p能级三个轨道、四个电子,依据泡利原理和洪特规则,先每个轨道排1个,方向相同,排满后再排,方向相反,故有两个孤对电子;硅,核电核数为14,根据构造原理可以排出。 (2)第一电离能同周期从左往右逐渐增大趋势,但有几个反常,故有Si<S;具有相同的电子层结构,核电荷越多半径越小,故有O2-<Na+;一般熔沸点原子晶体大于离子晶体;同周期从左到右非金属性逐渐增强,非金属性越强其最高价氧化物对应水化物的酸性越强。 (3)该反应为氧化还原反应,Cu从+1到+2价,O2做氧化剂,从0价到-2价。 (4)氯气做氧化剂从0价到-1价,亚氯酸根从+3到+4价。 |
相似问题
是一种食品添加剂 它与酸性溶液的反应方程式为: 下列叙述中正确的是A.生成l mo1需消耗0.4mo
是一种食品添加剂,它与酸性溶液的反应方程式为:,下列叙述中正确的是A.生成l mo1需消耗0 4mo1B.反应过程中溶液的pH减小C.该反应中NO被还原D.X表示的粒子是
下列反应的离子方程式正确的是 A.Na2CO3溶液与NaHSO4溶液反应:CO32--+2H+=
下列反应的离子方程式正确的是A.Na2CO3溶液与NaHSO4溶液反应:CO32--+2H+=CO2↑+H2OB.向硫酸铵溶液中加入氢氧化钡溶液:Ba2++SO42-=BaSO4↓C.碘化钾溶
下列反应既属于化合反应 又属于氧化还原反应的是 [ ]A.Fe+2HCl=H2+FeCl2
下列反应既属于化合反应,又属于氧化还原反应的是 [ ]A.Fe+2HCl=H2+FeCl2 B.2FeCl2+Cl2=2FeCl3 C.CaO+H2O=Ca(OH)2 D.2Fe(OH)3 =Fe2O3 +3H2O
煤是重要的能源 也是生产化工产品的重要原料。试用所学知识 解答下列问题:(1)煤的转化技术包括煤的气
煤是重要的能源,也是生产化工产品的重要原料。试用所学知识,解答下列问题:(1)煤的转化技术包括煤的气化技术和液化技术。煤的液化技术又分为________和
已知Ca(OH)2与Cl2反应的氧化产物与温度有关 在一定量的石灰乳中通入一定量的氯气 二者恰好完全
已知Ca(OH)2与Cl2反应的氧化产物与温度有关,在一定量的石灰乳中通入一定量的氯气,二者恰好完全反应(发生的反应均为放热反应)。生成物中含有Cl-、ClO-












