(10分)Ⅰ.已知NaHS04是一种酸式盐 在工业上应用广泛 根据NaHS04的性质回答下列问题:(
| (10分)Ⅰ.已知NaHS04是一种酸式盐,在工业上应用广泛,根据NaHS04的性质回答下列问题: (1)写出NaHS04在水溶液中的电离方程式: (2)若向NaHS04溶液中滴加Ba(OH)2至SO42-完全沉淀时的离子方程式为 (3)滴加Ba(0H)2溶液使溶液呈中性时的化学方程式为 Ⅱ.(4)若在标准状况下,将V L HCl气体溶于lL水中,所得溶液密度为dg/ml,则此溶液的物质的量浓度为 (5) 一定质量的铝铁合金溶于足量的NaOH溶液中,完全反应后产生3.36 L(标准状况下)气体;用同样质量的铝铁合金完全溶于足量的盐酸中,在标准状况下产生5.6 L(标准状况下)的气体,则该合金中铝、铁的物质的量之比为 |
参考解答
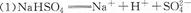 (2) 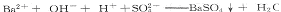 (3)2NaHSO4+Ba(OH)2=Na2SO4+BaSO4+2H2O (4)1000d/(36.5v+22400) (5)1:1 |
试题分析:Ⅰ.依据各类方程式书写的要求和题意要求书写,注意电荷守恒和方式式配平。 Ⅱ.(4)溶液的浓度可用质量分数和物质的量浓度两种不同的物理量来表示。溶液的质量为 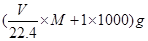 ,溶液的体积为 ,溶液的体积为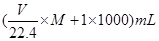 。则物质的量浓度为 。则物质的量浓度为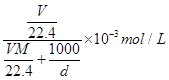 ,化简即得 ,化简即得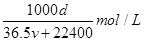 。 。(5)将铝铁合金溶于NaOH溶液中时,只有铝参与反应,而铁不反应,此时生成的3.36 L(即0.15 mol)氢气是由反应2Al+2NaOH+2H2O===2NaAlO2+3H2↑生成的,故合金中n(Al)=0.15 mol×=0.1 mol;当同样质量的合金与盐酸反应时,铝参与反应生成的H2为0.15 mol,则由Fe置换出的n(H2)=0.25 mol-0.15 mol=0.1 mol,即合金中含Fe的物质的量也为0.1 mol 点评:本题主要考查电离方程式、离子方程式、化学方程式的书写和化学计算,综合性较强,题目难度较大。 |
相似问题
离子方程式:CO32- + 2H2+ = CO2↑ + H2O表示 ( )A.碳酸盐和盐酸盐之间
离子方程式:CO32- + 2H2+ = CO2↑ + H2O表示()A.碳酸盐和盐酸盐之间的反应B.一切碳酸盐与一切酸之间的反应C.可溶性碳酸盐与酸之间的反应D.
下列化学反应的离子方程式正确的是A.用小苏打治疗胃酸过多:HCO32-+H+===CO2↑+H2OB
下列化学反应的离子方程式正确的是A.用小苏打治疗胃酸过多:HCO32-+H+===CO2↑+H2OB.往碳酸镁中滴加稀盐酸:CO32-+2H+===CO2↑+H2OC.往澄清石灰
下列离子方程式正确的是A.氯化铁溶液中加入铜粉:Fe3++Cu=Fe2++Cu2+B.等体积 等物质
下列离子方程式正确的是A.氯化铁溶液中加入铜粉:Fe3++Cu=Fe2++Cu2+B.等体积、等物质的量浓度的NH4HCO3和Ca(OH)2溶液混合:HCO3-+Ca2++OH-=C
下列离子方程式正确的是A.用FeCl3溶液腐蚀铜线路板:Cu + Fe3+= Cu2+ + Fe2+
下列离子方程式正确的是A.用FeCl3溶液腐蚀铜线路板:Cu + Fe3+= Cu2+ + Fe2+B.Na与H2O反应制备H2: 2Na+2H2O==2Na++2OH-+H2↑C.将氯气溶于水:
将a L(标准状况)CO2通入100mL 3mol·L-1 NaOH溶液中 下列各项为通入CO2过程
将a L(标准状况)CO2通入100mL 3mol·L-1 NaOH溶液中,下列各项为通入CO2过程中溶液内发生反应的离子方程式,其中不正确的是()A.a =3 36时,CO2












