(13分)X Y Z R为前四周期元素 且原子序数依次增大。XY2是红棕色气体;X与氢元素可形成XH
| (13分)X、Y、Z、R为前四周期元素,且原子序数依次增大。XY2是红棕色气体;X与氢元素可形成XH3;Z基态原子的M层与K层电子数相等;R2+离子的3d轨道中有9个电子。请回答下列问题: (1)Y基态原子的电子排布式是________;Z所在周期中第一电离能最大的主族元素是_____。 (2)XY2-离子的立体构型是_______;R2+的水合离子中,提供孤电子对的是原子是______。 (3)Z与某元素形成的化合物的晶胞如右图所示,晶胞中阴离子与阳离子的个数之比是___________。 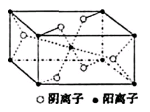 (4)将R单质的粉末加入XH3的浓溶液中,通入Y2,充分反应后溶液呈深蓝色,该反应的离子方程式是____________。 |
参考解答
| (1)1s22s22p4;Cl (2)V形;O (3)2:1 (4)2Cu+8NH3·H2O+O2=2[Cu(NH3)42++4OH-+6H2O |
试题分析:X、Y、Z、R为前四周期元素,且原子序数依次增大。XY2是红棕色气体,该气体是NO2,则X是氮元素,Y是氧元素;X与氢元素可形成XH3,该气体是氨气;Z基态原子的M层与K层电子数相等,则该元素的原子序数是2+8+2=12,即为镁元素;R2+离子的3d轨道中有9个电子,因此R的原子序数是18+9+2=29,即为铜元素。 (1)氧元素的原子序数是8,则根据核外电子排布规律可知,氧元素基态原子的电子排布式是1s22s22p4;同周期自左向右元素的第一电离能逐渐增大,镁是第三周期,则所在周期中第一电离能最大的主族元素是Cl元素。 (2)根据价层电子对互斥理论可知,NO2-离子中心原子氮原子含有的孤对电子对数= 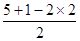 =1,即氮原子的价层电子对数是3,由于含有一对孤对电子,因此其离子的立体构型是V形;铜离子含有空轨道,而水分子中的氧原子含有孤对电子,因此在Cu2+的水合离子中,提供孤电子对的是原子是O原子。 =1,即氮原子的价层电子对数是3,由于含有一对孤对电子,因此其离子的立体构型是V形;铜离子含有空轨道,而水分子中的氧原子含有孤对电子,因此在Cu2+的水合离子中,提供孤电子对的是原子是O原子。(3)根据晶胞结构可知,阳离子在8个顶点和体心处各一个,则根据均摊法可知,阳离子个数=1+8× 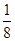 =2个。阴离子在上下面各2个,晶胞内部2个,则阴离子个数=4× =2个。阴离子在上下面各2个,晶胞内部2个,则阴离子个数=4×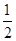 +2=4个,因此晶胞中阴离子与阳离子的个数之比是4:2=2:1。 +2=4个,因此晶胞中阴离子与阳离子的个数之比是4:2=2:1。(4)将R单质的粉末加入氨气的浓溶液中,通入氧气,充分反应后溶液呈深蓝色,这说明在反应中铜被氧化氧化为铜离子与氨气结合形成配位键,则该反应的离子方程式是2Cu+8NH3·H2O+O2=2[Cu(NH3)42++4OH-+6H2O。 |
相似问题
如表所示的五种元素中 W X Y Z为短周期元素 这四种元素的原子最外层电子数之和为22。下列说法正
如表所示的五种元素中,W、X、Y、Z为短周期元素,这四种元素的原子最外层电子数之和为22。下列说法正确的是()A.X、Y、Z三种元素最低价氢化物的沸点依
下列关于碱金属元素和卤素的说法中 错误的是( )A.随核电荷数的增加 碱金属元素和卤素的熔沸点都
下列关于碱金属元素和卤素的说法中,错误的是()A.随核电荷数的增加,碱金属元素和卤素的熔沸点都逐渐降低 B.碱金属元素中,锂原子失去最外层电子的
(10分)短周期元素A B C D E原子序数依次增大 A与C可形成A2C2和A2C两种化合物;B的
(10分)短周期元素A、B、C、D、E原子序数依次增大,A与C可形成A2C2和A2C两种化合物;B的最高价氧化物对应的水化物甲与其气态氢化物乙反应可生成盐丙;D与A
若某ⅡB族元素原子序数为x 那么原子序数为x+1的元素位于A.ⅢA族B.ⅢB族C.ⅠB族D.ⅠA族
若某ⅡB族元素原子序数为x,那么原子序数为x+1的元素位于A.ⅢA族B.ⅢB族C.ⅠB族D.ⅠA族
下列有关物质性质的说法错误的是A.热稳定性:HCl> HIB.原子半径:Na> MgC.酸性:H2S
下列有关物质性质的说法错误的是A.热稳定性:HCl> HIB.原子半径:Na> MgC.酸性:H2SO3>H2SO4。D.结合质子能力:S2-> Cl-












