常温下 金属钠和氧气反应的产物(氧化钠)中总会混杂少量的过氧化钠。因此 生产中用金属钠制备氧化钠 采
常温下,金属钠和氧气反应的产物(氧化钠)中总会混杂少量的过氧化钠。因此,生产中用金属钠制备氧化钠,采用以下反应:2NaNO2+6Na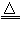 4Na2O +N2↑。 4Na2O +N2↑。(1)上述反应的氧化剂是________,氧化产物是________; (2)采用上述方法的主要原因是________________________。 |
参考解答
| (1)NaNO2;Na2O (2)反应生成的N2隔绝了空气中的O2,不致使Na2O被O2氧化 |
相似问题
下列变化需加入氧化剂才能实现的是[ ]A.Fe3+→Fe2+ B.CuO→Cu C.Cl-
下列变化需加入氧化剂才能实现的是[ ]A.Fe3+→Fe2+ B.CuO→Cu C.Cl- →Cl2 D.H2SO4→BaSO4
元素从化合物中被置换成单质时 该元素 [ ]A 一定被氧化 B 一定被还原 C 可能被氧化
元素从化合物中被置换成单质时,该元素 [ ]A、一定被氧化 B、一定被还原 C、可能被氧化,也可能被还原D、既不被氧化,也不被还原
反应2KMnO4+16HCl(浓)= 2MnCl2+2KCl+5Cl2↑+8H2O中 (1)氧化剂是
反应2KMnO4+16HCl(浓)= 2MnCl2+2KCl+5Cl2↑+8H2O中,(1)氧化剂是______,氧化产物是_______(均填化学式)。(2)若生成71g Cl2,则消耗的HCl是_____mo
已知Fe3O4可表示成(FeO·Fe2O3) 水热法制备Fe3O4纳米颗粒的总反应为:3Fe2++2
已知Fe3O4可表示成(FeO·Fe2O3),水热法制备Fe3O4纳米颗粒的总反应为:3Fe2++2S2O+O2+4OH-=Fe3O4+S4O62-+2H2O,下列说法正确的是[ ]A.O2和S2O是氧化
在高温时 水蒸气与灼热的铁粉反应的化学方程式是:4H2O+3FeFe3O4+4H2 其中 水是___
在高温时,水蒸气与灼热的铁粉反应的化学方程式是:4H2O+3FeFe3O4+4H2,其中,水是________剂。磷在氧气中燃烧的化学方程式是________________,其中,磷是___________剂。












