在溶液中较难制得纯净的Fe(OH)2 原因是Fe(OH)2不稳定 在水中只要有一点氧气就极易反应生成
| 在溶液中较难制得纯净的Fe(OH)2,原因是Fe(OH)2不稳定,在水中只要有一点氧气就极易反应生成红褐色沉淀Fe(OH)3. 写出其反应的化学方程式:______. 用下面两种精心设计的方法可以制得白色的Fe(OH)2沉淀. 方法一: 用不含氧气的蒸馏水配置FeSO4溶液与NaOH溶液,然后反应制备. a.除去蒸馏水中溶解的氧气,常采用______的方法. b.如图所示,用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液.试管中油层的作用是______. 方法二: 用如图2装置来制备. a在装置Ι中加入Fe和稀H2SO4,写出其反应的化学方程式______;在装置Ⅱ中加入NaOH浓溶液. b为了制得白色Fe(OH)2沉淀,需要下列步骤,其顺序为______ ①气密性检查 ②气体验纯 ③加入试剂塞紧橡皮塞 ④打开止水夹 ⑤夹紧止水夹. c.写出试管Ⅱ中发生的化学反应方程式______、______.这样生成的Fe(OH)2沉淀能较长时间保持白色. 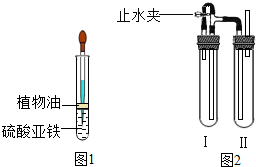 |
参考解答
| 根据Fe(OH)2不稳定,在水中,只要有一点氧气就极易发生反应生成Fe(OH)3,可推出反应物为Fe(OH)2、水、氧气生成物为Fe(OH)3利用奇偶法配平,方程式是 4Fe(OH)2+2H2O+O2═4Fe(OH)3; 方法一: a、由于气体的溶解度与温度成反比,所以煮沸即可将水中的氧气除去; b、注入植物油防止空气中氧气进入; (3)用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下也是为了防止空气中氧气进入; 方法二:a、Fe和稀H2SO4反应生成硫酸亚铁和氢气,已经平了,注意上升符号的标法; b、有关气体的制取,所以要检查装置的气密性,检查完毕在装置中加入试剂并塞上塞子,打开止水夹,Ⅰ中生成氢气进入装置Ⅱ,要检验装置Ⅱ中空气是否排尽,要在装置Ⅱ导管口检验气体的纯度,待气体纯净,关闭止水夹,Ⅰ中气压增大,使Ι中的药品进入Ⅱ中,与Ⅱ中的药品反应得到氢氧化亚铁; c、由于铁与硫酸反应生成了硫酸亚铁,可能还有没反应的硫酸;氢氧化钠与硫酸亚铁反应生成氢氧化亚铁沉淀和硫酸钠,氢氧化钠与硫酸反应生成硫酸钠和水,硫酸与氢氧化亚铁反应生成硫酸亚铁和水; 故答案为: 4Fe(OH) 2+O2+2H2O═4Fe(OH)3; 方法一:a.加热; b.隔绝空气,避免氧气的干扰; 方法二:a.Fe+H2SO4═FeSO4+H2↑; b.①③④②⑤; c.FeSO4+2NaOH═Fe(OH)2↓+Na2SO4(必写); H2SO4+2NaOH═Na2SO4+2H2O (或H2SO4+Fe(OH)2═FeSO4+2H2O). |
相似问题
选用“>” “<”或“=”填空:(1)沸点:氯化钠稀溶液______水;(2)熔点:水银______
选用“>”、“<”或“=”填空:(1)沸点:氯化钠稀溶液______水;(2)熔点:水银______铝;(3)含碳量:钢______生铁;(4)氢氧化钙的溶解度:20℃______60℃.
研究发现 空气中少量的NO2能参与SO2转化为硫酸的反应.反应过程如下①SO2+NO2→SO3+NO
研究发现,空气中少量的NO2能参与SO2转化为硫酸的反应.反应过程如下①SO2+NO2→SO3+NO②SO3+H2O→H2SO4③2NO+O2→2NO2下列说法正确的是( )A.常温
下列物质的转化能实现的是[ ]A.H2SO4HClB.CONa2CO3C.Cu(OH)2Na
下列物质的转化能实现的是[ ]A.H2SO4HClB.CONa2CO3C.Cu(OH)2NaOHD.NaNO3Ba(NO3)2
无水硫酸铜(CuSO4)是白色粉末 具有很强的吸水性.吸水后白色粉末转化为蓝色晶体﹣胆矾(CuSO4
无水硫酸铜(CuSO4)是白色粉末,具有很强的吸水性.吸水后白色粉末转化为蓝色晶体﹣胆矾(CuSO4·5H2O).(1)露置在空气中的无水硫酸铜吸收水蒸汽得到
下列物质的制备 能由一步反应实现的是( )A.KNO3→KOHB.Fe2O3→Fe(OH)3C.C
下列物质的制备,能由一步反应实现的是( )A.KNO3→KOHB.Fe2O3→Fe(OH)3C.Cu→Cu(NO3)2D.CaCO3→Ca(OH)2












