氮氧化物是大气污染物之一 消除氮氧化物的方法有多种。(1)利用甲烷催化还原氮氧化物。已知:CH4 (
氮氧化物是大气污染物之一,消除氮氧化物的方法有多种。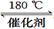 (1)利用甲烷催化还原氮氧化物。已知: CH4 (g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H =-574 kJ/mol CH4(g)+4NO(g) = 2N2(g)+CO2(g)+2H2O(g) △H =-1160 kJ/mol 则CH4 将NO2 还原为N2 的热化学方程式为 。 (2)利用NH3催化还原氮氧化物(SCR技术)。该技术是目前应用最广泛的烟气氮氧化物脱除技术。 反应的化学方程式为:2NH3(g)+NO(g)+NO2(g)  2N2(g)+3H2O(g) ΔH < 0 2N2(g)+3H2O(g) ΔH < 0为提高氮氧化物的转化率可采取的措施是 (写出1条即可)。 (3)利用ClO2氧化氮氧化物。其转化流程如下: NO 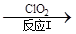 NO2 NO2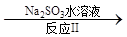 N2 N2已知反应Ⅰ的化学方程式为2NO+ ClO2 + H2O = NO2 + HNO3 + HCl,则反应Ⅱ的化学方程式是 ;若生成11.2 L N2(标准状况),则消耗ClO2 g 。 (4)利用CO催化还原氮氧化物也可以达到消除污染的目的。 已知质量一定时,增大固体催化剂的表面积可提高化学反应速率。如图是反应2NO(g) + 2CO(g)  2CO2(g)+ N2(g) 中NO的浓度随温度(T)、等质量催化剂表面积(S)和时间(t)的变化曲线。据此判断该反应的△H 0 (填“>”、“<”或“无法确定”);催化剂表面积S1 S2 (填“>”、“<”或“无法确定”)。 2CO2(g)+ N2(g) 中NO的浓度随温度(T)、等质量催化剂表面积(S)和时间(t)的变化曲线。据此判断该反应的△H 0 (填“>”、“<”或“无法确定”);催化剂表面积S1 S2 (填“>”、“<”或“无法确定”)。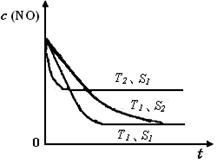 |
参考解答
| (1)CH4 (g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H =-867 kJ/mol (3分) (2)增大NH3的浓度或减小反应体系的压强或降低反应体系的温度等(合理答案也计分) (3)2NO2 + 4 Na2SO3 = N2 + 4 Na2SO4 67.5 (4)< > |
试题分析:(1)将已知的两个热化学方程式相加除以2即得,答案为CH4 (g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H =-867 kJ/mol (2)提高氮氧化物的转化率即使反应正向进行,根据勒夏特列原理,可采取增大NH3的浓度或减小反应体系的压强或降低反应体系的温度等措施; (3)反应Ⅱ中反应物为NO2、Na2SO3,产物之一有N2,根据氧化还原反应理论,可推断另一产物为Na2SO4化学方程式是2NO2 + 4 Na2SO3 = N2 + 4 Na2SO4;若生成11.2 L N2(标准状况),其物质的量为0.5mol,消耗NO2的物质的量为1mol,从而可计算出消耗ClO2的质量为67.5g; (4)根据化学平衡中的“先拐先平”规律,温度高的先达平衡,表面积大的速率快,先达平衡,所以T2>T1,S1>S2,随温度升高,CO的浓度增大,说明升温平衡逆向移动,正向是放热反应△H<0。 |
相似问题
将Cu与CuO的混合物20.8g加入到50mL 18.4mol/L浓H2SO4中 加热充分反应至固体
将Cu与CuO的混合物20.8g加入到50mL 18.4mol L浓H2SO4中,加热充分反应至固体物质完全溶解(产生气体全部逸出),冷却后将溶液稀释至1000ml,测得c(H+)=0
金属元素M的常见化合价有+4和+6 其与氮 氧元素组成的化合物MO2(NO3)2受热可发生的分解反应
金属元素M的常见化合价有+4和+6,其与氮、氧元素组成的化合物MO2(NO3)2受热可发生的分解反应为:MO2(NO3)2→MxOy + NO2↑+ O2↑ 在600K 时,将气体
向27.2 g Cu和Cu2O的混合物中加入某浓度的稀硝酸0.5 L 固体物质完全反应 生成NO和C
向27 2 g Cu和Cu2O的混合物中加入某浓度的稀硝酸0 5 L,固体物质完全反应,生成NO和Cu(NO3)2。在所得溶液中加入1 0 mol·L-1的NaOH溶液1 0 L,此时
某含铬[Cr2O72-] 废水用硫酸亚铁铵[FeSO4·(NH4)2SO4·6H2O]处理 反应中铁
某含铬[Cr2O72-] 废水用硫酸亚铁铵[FeSO4·(NH4)2SO4·6H2O]处理,反应中铁元素和铬元素完全转化为沉淀,该沉淀干燥后得到n molFeO·FeyCrxO3。不考
将一定量的锌与100 mL 18.5 mol/L的浓硫酸充分反应后 锌完全溶解 同时生成气体A 33
将一定量的锌与100 mL 18 5 mol L的浓硫酸充分反应后,锌完全溶解,同时生成气体A 33 6 L(标准状况)。将反应后的溶液稀释至1 L,测得溶液中c(H+












