利用I2O5可消除CO污染或定量测定CO 反应为:5CO(g)+I2O5(s) 5CO2(g)+I2
利用I2O5可消除CO污染或定量测定CO,反应为:5CO(g)+I2O5(s) 5CO2(g)+I2(s);ΔH 1 5CO2(g)+I2(s);ΔH 1(1)已知:2CO(g)+O2(g)  2CO2(g);ΔH 2 2CO2(g);ΔH 22I2(s)+5O2(g)  2I2O5(s);ΔH 3 2I2O5(s);ΔH 3则ΔH 1= (用含ΔH 2和ΔH 3的代数式表示)。 (2)不同温度下,向装有足量I2O5固体的2 L恒容密闭容器中通入2molCO,测得CO2的体积分数φ(CO2)随时间t变化曲线如图。请回答: 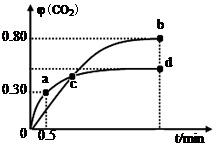 ①从反应开始至a点时的反应速率为v(CO)= ,b点时化学平衡常数Kb= 。 ②d点时,温度不变,若将容器体积压缩至原来的一半,请在图中补充画出CO2体积分数的变化曲线。 ③下列说法正确的是 。(填字母序号)
|
参考解答
| (1)2.5ΔH2-0.5ΔH3(3分) (2)①0.6mol·L-1·min-1(2分,不带单位扣1分),1024 或者45(3分) ② 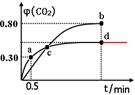 ③AB(2分,选对一个得1分,有错选得0分) (3)8.96%(3分,三位有效数字,错误扣1分) |
试题分析:(1)根据盖斯定律,对照第1个反应和第2个反应中CO,对照第1个反应和第3个反应中I2或I2O5,可得ΔH 1=2.5ΔH2-0.5ΔH3。 (2)①设转化的CO物质的量浓度为x,根据三段式进行计算: 5CO(g)+I2O5(s)  5CO2(g)+I2(s) 5CO2(g)+I2(s) 起始浓度(mol?L ̄1) 1 0 转化浓度(mol?L ̄1) x x 平衡浓度(mol?L ̄1) 1-x x a点CO2的体积分数为0.3,则x/1=0.3,可得x=0.3mol?L ̄1,则v(CO)=0.3mol/L÷0.5min = 0.6mol·L-1·min-1;类似a点计算,可求出b点CO的平衡浓度为0.2mol?L ̄1,CO2的 平衡浓度为0.8mol?L ̄1,则b点时化学平衡常数Kb=c5(CO2)÷c5(CO)=0.85÷0.25=45。 ②d点时,温度不变,若将容器体积压缩至原来的一半,压强增大,因为该反应前后气体的系数相等,所以增大压强,平衡不移动,CO2的体积分数不变,可画出CO2体积分数的变化曲线。 ③A、容器内气体密度不变,说明气体的质量不变,则反应达到平衡状态,正确;B、c点时两温度下CO2的体积分数相等,说明气体组成相同,则体系中混合气体的平均相对分子质量相等,正确;C、因为I2O5为固体,增加I2O5的投料量,CO的转化率不变,错误;D、b点CO2的体积分数大,说明b点平衡常数大,所以Kb > Kd,错误。 (3)根据化学方程式可得对应关系:5CO ~ I2~2Na2S2O3,n(CO)=5/2n(Na2S2O3)=5/2×0.0100mol·L-1×0.02L×4=0.002mol,则样品气中CO的体积分数为:0.002mol×22.4L/mol÷0.5L×100%=8.96% |
相似问题
已知OCN-中每种元素都满足8电子稳定结构 在反应OCN-+OH-+Cl2―→CO2+N2+Cl-+
已知OCN-中每种元素都满足8电子稳定结构,在反应OCN-+OH-+Cl2―→CO2+N2+Cl-+H2O(未配平)中,如果有6 mol Cl2完全反应,则被氧化的OCN-的物
将51.2 g Cu完全溶于适量浓硝酸中 收集到氮的氧化物(含NO N2O4 NO2)的混合物共0.
将51.2 g Cu完全溶于适量浓硝酸中,收集到氮的氧化物(含NO、N2O4、NO2)的混合物共0.8 mol,这些气体恰好能被500 mL 2 mol L NaOH溶液完全吸收,
水热法制备Fe(FeO2)2纳米颗粒的反应3Fe2++2S2O32-+O2 +xOH-=Fe(FeO
水热法制备Fe(FeO2)2纳米颗粒的反应3Fe2++2S2O32-+O2 +xOH-=Fe(FeO2)2+S4O62-+2H2O下列说法中不正确的是A.每生成1mol Fe(FeO2)2转移4mol电子B.该反
在一百多种化学元素中 非金属占了23种。80%的非金属元素在社会中占重要位置。如C N O Si C
在一百多种化学元素中,非金属占了23种。80%的非金属元素在社会中占重要位置。如C、N、O、Si、Cl等。(1)氯元素原子最外电子层上有种能量不同的电子,该
下列物质的转化 需要加入氧化剂才能实现的是( )A.Na→Na+B.Cl2→HClC.SO32-→
下列物质的转化,需要加入氧化剂才能实现的是( )A.Na→Na+B.Cl2→HClC.SO32-→SO2D.SO2→S












