哈尔滨市场销售的某种食用精制盐包装袋上有如下说明(1)碘酸钾与碘化钾在酸性条件下发生如下反应 配平化
| 哈尔滨市场销售的某种食用精制盐包装袋上有如下说明 |
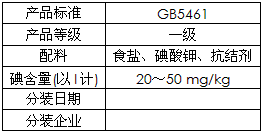 |
| (1)碘酸钾与碘化钾在酸性条件下发生如下反应,配平化学方程式(将化学计量数填于空白处): ___KIO3+___KI+___H2SO4 =___K2SO4+___I2+___H2O (2)上述反应生成的I2可用四氯化碳检验。向碘的四氯化碳溶液中加入Na2SO3稀溶液,将I2还原,以回收四氯化碳。 ①Na2SO3稀溶液与I2反应的离子方程式是_______________________。 ②某学生设计回收四氯化碳的操作步骤为: a.将碘的四氯化碳溶液置于分液漏斗中; b.加入适量Na2SO3稀溶液; c.分离出下层液体。 以上设计中遗漏的操作及在上述步骤中的位置是__________________________。 (3)已知:I2+2S2O32-== 2I-+S4O62-。某学生测定食用精制盐的碘含量,其步骤为: a.准确称取wg食盐,加适量蒸馏水使其完全溶解; b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全; c.以淀粉溶液为指示剂,逐滴加入物质的量浓度为2.0×10-3mol/L的Na2S2O3溶液10.0 mL,恰好反应完全。 ①判断c中反应恰好完全依据的现象是___________________。 ②b中反应所产生的I2的物质的量是____________mol。 ③根据以上实验和包装袋说明,所测精制盐的碘含量是(以含w的代数式表示) _______________mg/kg。 |
参考解答
| (1)1、5、3、3、3、3 (2)①I2+SO32-+H2O==2I-+2H++SO42-;②步骤后增加:将分液漏斗充分振荡后静置 (3)①溶液由蓝色恰好变为无色且半分钟内不恢复至原来颜色;②1×10-5;③ 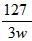 |
相似问题
硫化氢与二氧化硫反应生成了32g单质硫 则氧化产物和还原产物的质量之比是( )A.1:2B.1:
硫化氢与二氧化硫反应生成了32g单质硫,则氧化产物和还原产物的质量之比是()A.1:2B.1:3 C.1:1D.2:1
已知下列变化过程中 有一个RxO72-离子反应时 反应就转移6个电子 ______RxO72-+__
已知下列变化过程中,有一个RxO72-离子反应时,反应就转移6个电子,______RxO72-+______Fe2++______H+=______R3++______Fe3++______H2O(1)X值______;
随着材料科学的发展 金属钒及其化合物得到了越来越广泛的应用 并被誉为“合金的维生素”。钒元素广泛分散
随着材料科学的发展,金属钒及其化合物得到了越来越广泛的应用,并被誉为“合金的维生素”。钒元素广泛分散于各种矿物中,钾钒铀矿的主要成分可用化学式
将n molCu2S的与足量的稀硝酸反应 生成硝酸铜 硫酸 一氧化氮和水 则参加反应的硝酸中被还原的
将n molCu2S的与足量的稀硝酸反应,生成硝酸铜、硫酸、一氧化氮和水,则参加反应的硝酸中被还原的硝酸的物质的量是A.4n molB.10n molC.10n 3 molD.2n 3 mol
已知Cu2S与一定浓度的HNO3可发生以下反应: 3Cu2S+26HNO3=3CuSO4+3Cu(N
已知Cu2S与一定浓度的HNO3可发生以下反应: 3Cu2S+26HNO3=3CuSO4+3Cu(NO3)2+15NO2↑+5 NO↑+13H2O下列说法正确的是()A.Cu2S既是还原剂,又是












