分析下列反应:5KCl+KClO3+3H2SO4=3Cl2↑+3K2SO4+3H2O 据此作答:(1
| 分析下列反应:5KCl+KClO3+3H2SO4=3Cl2↑+3K2SO4+3H2O,据此作答: (1)标出该反应中电子的转移方向和数目:5KCl+KClO3+3H2SO4=3Cl2↑+3K2SO4+3H2O (2)该反应的氧化剂是______. (3)该反应的氧化产物与还原产物的质量比是______. (4)当反应生成0.3mol Cl2时,则转移的电子的物质的量是______. |
参考解答
(1)该反应中氯化钾中氯元素化合价由-1价变为0价,氯酸钾中氯元素的化合价由+5价变为0价,所以其转移电子数是5,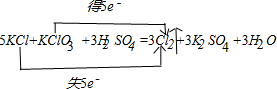 , 故答案为: 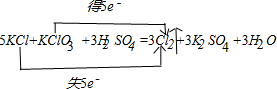 ; (2)该反应中,氯酸钾中氯元素的化合价由+5价变为0价,所以氯酸钾是氧化剂,故答案为:KClO3; (3)该反应中还原剂是氯化钾,氧化剂是氯酸钾,则氧化产物是氯气,还原产物也是氯气,氧化产物和还原产物的质量之比是5:1,故答案为:5:1; (4)当反应生成0.3mol Cl2时,则转移的电子的物质的量=0.3mol×5=0.5 mol, 故答案为:0.5mol. |
相似问题
据悉 奥运会上使用的发令枪所用的“火药”成分是氯酸钾和红磷 经撞击发出响声 同时产生白色烟雾.撞击时
据悉,奥运会上使用的发令枪所用的“火药”成分是氯酸钾和红磷,经撞击发出响声,同时产生白色烟雾.撞击时发生反应的化学方程式为:5KClO3+6P=3P2O5+5KC
下列变化中 需加氧化剂才能实现的是( )A.CO2→CO32-B.C→CO2C.FeCl3→FeC
下列变化中,需加氧化剂才能实现的是( )A.CO2→CO32-B.C→CO2C.FeCl3→FeCl2D.HCl→MgCl2
按照要求完成下列化学方程式:(1)工业上将氯气通入石灰乳制取漂白粉 反应的化学反应方程式为_____
按照要求完成下列化学方程式:(1)工业上将氯气通入石灰乳制取漂白粉,反应的化学反应方程式为______.(2)瓶装漂白粉久置空气中会呈稀粥状而失效,试
将1.4g纯铁粉放入80ml 1mol/L的稀HNO3 中 反应停止后 生成的硝酸盐的成分是____
将1 4g纯铁粉放入80ml1mol L的稀HNO3中,反应停止后,生成的硝酸盐的成分是______其物质的量是______被还原的硝酸的质量是______.
化合物BrFx能够与水反应 产物有溴酸 氢氟酸 单质溴和氧气 则下列关于该反应的说法正确的是( )
化合物BrFx能够与水反应,产物有溴酸、氢氟酸、单质溴和氧气,则下列关于该反应的说法正确的是( )A.BrFx是还原剂,HF是氧化产物B.水是氧化剂,O2












