(14分)过氧化钠常用做漂白剂 杀菌剂 消毒剂。过氧化钠保存不当容易变质。(1)某课外活动小组欲探究
| (14分)过氧化钠常用做漂白剂、杀菌剂、消毒剂。过氧化钠保存不当容易变质。 (1)某课外活动小组欲探究一包过氧化钠样品是否已经变质: 取少量样品,溶解,加入_______溶液,充分振荡后有白色沉淀,证明Na2O2已经变质。 (2)该课外活动小组为了粗略测定过氧化钠的质量分数,他们称取ag样品,并设计用下图装置来测定过氧化钠的质量分数。 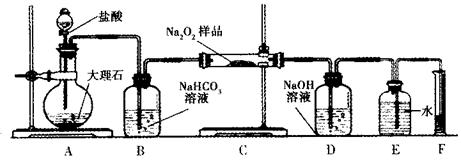 ①将仪器连接好以后,必须进行的第一步操作是_______。 ②写出装置C中发生反应的化学方程式:_______。 ③实验结束时,在读取实验中生成气体的体积时,你认为合理的是_______ (填选项编号)。 a.直接读取气体体积,不需冷却到室温 b.调整量筒内外液面高度使之相同 c.视线与凹液面的最低点相平读取量筒中水的体积 ④读出量筒内水的体积后,折算成标准状况下氧气的体积为VmL,则样品中过氧化钠的质量分数为_______。 ⑤本实验方案存在的缺陷是_______。 |
参考解答
| (14分)(1)BaCl2溶液(2分)(合理答案都给分) (2)①检查装置的气密性(2分) ②2CO2+ 2Na2O2= 2Na2CO3+O2(3分) ③bc(2分) ④ 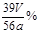 (3分) (3分)⑤E到F之间导管内水的体积没有办法测量会引起误差(2分)(答案合理都给分) |
试题分析:(1)Na2O2易变质,与空气中CO2反应,生成Na2CO3,Na2CO3与BaCl2溶液或Ba(NO3)2溶液等易反应,生成白色BaCO3沉淀,而Na2O2与水反应所得溶液不能与BaCl2溶液或Ba(NO3)2溶液反应;(2)①根据题意,该实验成功的关键是准确测量反应生成氧气的体积,因此必须检查整套装置是否漏气;②图中A、B、C、D、E、F装置的目的分别是制取CO2、除去CO2中混有的HCl、制取氧气、除去O2混有的CO2、收集氧气、量取氧气的体积,则C中主要反应式为2CO2+2Na2O2=2Na2CO3+O2;③a、C中反应是放热反应,产生的氧气温度高于室温,故不冷却读数导致氧气体积偏大,错误;b、量筒内外液面高度不相同,氧气的压强与外界大气压不同,导致氧气体积不准确,错误;平视读数,氧气的体积等于量筒中水的体积,正确;④由V/Vm可知n(O2)= 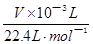 ,由反应式2CO2+2Na2O2=2Na2CO3+O2可知,n(Na2O2)=2n(O2)=2× ,由反应式2CO2+2Na2O2=2Na2CO3+O2可知,n(Na2O2)=2n(O2)=2×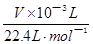 ,由n?M可知,m(O2)=2× ,由n?M可知,m(O2)=2×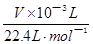 ×78g?mol—1,则样品中Na2O2的质量分数= ×78g?mol—1,则样品中Na2O2的质量分数=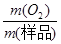 ×100%= ×100%=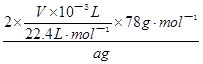 ×100%= ×100%=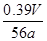 ×100%或 ×100%或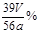 ;⑤该实验成功的关键是准确测量反应生成氧气的体积,E到F之间导管内水的体积没有办法测量会引起误差。2的制备、气体的收集、量气原理、气体体积、物质的量及其在化学方程式计算中的应用等相关知识。 ;⑤该实验成功的关键是准确测量反应生成氧气的体积,E到F之间导管内水的体积没有办法测量会引起误差。2的制备、气体的收集、量气原理、气体体积、物质的量及其在化学方程式计算中的应用等相关知识。 |
相似问题
有关钠的叙述不正确的是( )A.少量钠应保存在煤油中 实验后剩余的钠需放回原瓶B.2.3g钠与9
有关钠的叙述不正确的是()A.少量钠应保存在煤油中,实验后剩余的钠需放回原瓶B.2.3g钠与97.7g 水反应后溶液中溶质的质量分数大于4%C.钠与CuSO4溶
(10 分)(1)明矾的组成为 明矾的用途
(10 分)(1)明矾的组成为,明矾的用途,其在水中的电离方程式是。(2)除去Na2CO3粉末中混入的NaHCO3杂质用 方法,化学方程式为
一定温度下 向饱和NaOH溶液中加入一定量的钠块 充分反应后恢复到原来温度 下列说法正确的是A.溶液
一定温度下,向饱和NaOH溶液中加入一定量的钠块,充分反应后恢复到原来温度,下列说法正确的是A.溶液中溶质质量增加,溶剂量减少,溶液的溶质质量分数变
观察是研究物质性质的一种基本方法.一同学将一小块金属钠露置于空气中 观察到下列现象:银白色变灰暗变白
观察是研究物质性质的一种基本方法.一同学将一小块金属钠露置于空气中,观察到下列现象:银白色变灰暗变白色出现液滴白色固体,下列说法正确的是A.①发
事实上 许多氧化物在一定条件下能与Na2O2反应 且反应极有规律 如Na2O2 +SO2 →Na2S
事实上,许多氧化物在一定条件下能与Na2O2反应,且反应极有规律,如Na2O2 +SO2 →Na2SO4;2Na2O2 +2SO3→2Na2SO4 +O2 ,据此你认为下列反应方程式中












