工业生产纯械的工艺流程示意图如下完成下列填空:(1)粗盐水加入沉淀剂A B除杂质(A来源于石灰窑厂)
工业生产纯械的工艺流程示意图如下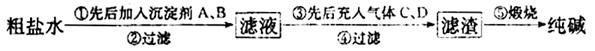 完成下列填空: (1)粗盐水加入沉淀剂A、B除杂质(A来源于石灰窑厂),则B的化学式_________。 (2)②过滤后滤液中要通入C和D气体,则先通入的C气体是_________(填化学式),原因是_________。 (3)通入C和D气体后发生反应的化学方程式是_________。 (4)④过滤后,向滤液中通氨气,加入细小食盐颗粒,析出副产品________ (填写化学式),通氨气与加入细小食盐颗粒的作用是_________。 (5)写出⑤锻烧发生反应的化学方程式_________。产品纯碱中含有碳酸氢钠,若用加热分解的方法测定纯碱中碳酸氢钠的质量分数,纯碱中碳酸氢钠的质童分数ω(NaHCO3)= _________ (注明表达式中所用的有关符号的含义)。 |
参考解答
| (每空2分,第(1)问1分,共计15分)(1)Na2CO3 (2)NH3;因为在CO2水中的溶解度小,而NH3溶解度大 (3)NaCl+CO2+NH3+H2O=NaHCO3↓+NH4Cl (4)NH4Cl;增大溶液中的Cl-、NH4+的浓度,降低NH4Cl的溶解度,使NH4Cl大量析出 (5)2NaHCO3  Na2CO3+CO2↑+H2O; Na2CO3+CO2↑+H2O;  |
试题分析:(1)粗盐提纯时需要除去的杂质离子是Ca2+、Mg2+,A来源于石灰窑厂,则A是生石灰或熟石灰,用来除去Mg2+,而Ca2+一般用碳酸钠来除去,即B试剂是碳酸钠。 (2)由于在CO2水中的溶解度小,而NH3溶解度大,所以要先通入氨气,然后再通入CO2气体。 (3)由于碳酸氢钠的溶解度较小,所以向氨气饱和的氯化钠溶液中通入CO2气体会产生碳酸氢钠晶体,反应的化学方程式是NaCl+CO2+NH3+H2O=NaHCO3↓+NH4Cl。 (4)由于溶液中含有氯离子和NH4+,所以加入细小食盐颗粒,增大溶液中的Cl-、NH4+的浓度,降低NH4Cl的溶解度,使NH4Cl大量析出,因此析出副产品是氯化铵。 (5)碳酸氢钠稳定性差,在加热的条件下能发生分解,反应的化学方程式为2NaHCO3  Na2CO3+CO2↑+H2O;假设加热前纯碱的质量为m(加热前),加热后的质量为m(加热后),则加热损失的质量为[m(加热前)-m(加热后),因此根据方程式可知,纯碱中碳酸氢钠的质量为 Na2CO3+CO2↑+H2O;假设加热前纯碱的质量为m(加热前),加热后的质量为m(加热后),则加热损失的质量为[m(加热前)-m(加热后),因此根据方程式可知,纯碱中碳酸氢钠的质量为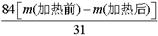 ,所以纯碱中含有的碳酸氢钠的质量分数为 ,所以纯碱中含有的碳酸氢钠的质量分数为 。 。 |
相似问题
在一定条件下可实现下列物质间的转化 如下图所示:(1)固体A是一种重要的工业原料 其化学式为____
在一定条件下可实现下列物质间的转化,如下图所示:(1)固体A是一种重要的工业原料,其化学式为____________________。W的电子式为_____ ____(2)写出
对于等物质的量浓度的Na2CO3和NaHCO3溶液 下列说法不正确的是A.分别升高温度 两种溶液的p
对于等物质的量浓度的Na2CO3和NaHCO3溶液,下列说法不正确的是A.分别升高温度,两种溶液的pH均减小B.相同温度下两种溶液的pH:Na2CO3> NaHCO3C.分别
测定Na2CO3和NaHCO3混合物中Na2CO3质量分数的实验方案不合理的是( )A.取a克
测定Na2CO3和NaHCO3混合物中Na2CO3质量分数的实验方案不合理的是( )A.取a克混合物充分加热,减重b克B.取a克混合物与足量稀盐酸充分反应,加热、蒸干、
标准状况下 向1L1.0mol/LNaOH溶液中通入17.92LCO2 充分反应后溶液中的CO32-
标准状况下,向1L1 0mol LNaOH溶液中通入17 92LCO2,充分反应后溶液中的CO32-,HCO3-的物质的量浓度之比为:A.2∶1B.1∶2C.1∶3D.1∶4
将2.3 g金属钠投入100 g水中 反应结束后 溶液中溶质的质量分数计算式表示正确的是( )A.
将2 3 g金属钠投入100 g水中,反应结束后,溶液中溶质的质量分数计算式表示正确的是( )A.B.C.D.












