(10分)A-G的转化关系如图所示(部分反应物 产物和反应条件未标出)已知:①A B为中学化学常见的
| (10分)A-G的转化关系如图所示(部分反应物、产物和反应条件未标出) 已知:①A、B为中学化学常见的金属单质;C-G均为化合物,并且E和G均含有3种元素;②C是淡黄色固体,D既能与强酸溶液反应,又能与强碱溶液反应;③F溶液中加入AgNO3溶液产生不溶于稀硝酸的白色沉淀;④E和G焰色反应均呈黄色。 根据以上信息回答下列问题: 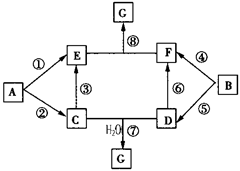 (1)写出物质G的化学式: (2)①-⑥反应中,不属于氧化还原反应的是 ; (3)反应③的离子方程式为 ; (4)反应⑦对应的总化学方程式为 ; (5)反应③中,若有31.2g C参加反应,转移电子的物质的量为 。 |
参考解答
(10分)(1) 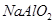 (2)⑥ (3) 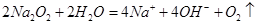 (4)2 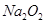 +2Al2O3===4 +2Al2O3===4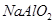 +O2↑ +O2↑(5)0.4mol |
| 无机推断重点是找到突破点 金属单质A、B可生成“淡黄色固体C”、“D既能与强酸溶液反应,又能与强碱溶液反应”,可猜定A、B分别为钠与铝,而C、D分别为Na2O2、Al2O3; 钠、Na2O2均可生成焰色反应呈黄色、含三种元素的E,可判定E为NaOH; 铝、Al2O3均可生成F,“F溶液中加入AgNO3溶液产生不溶于稀硝酸的白色沉淀”,也就是F含有氯元素,则可判定E为AlCl3; NaOH与AlCl3生成的G物质含有三种元素,且焰色反应为黄色,即G为 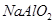 (2)涉及反应为①2Na+2H2O=2NaOH+H2↑ ②2Na+O2  Na2O2 ③2Na2O2+2H2O=4NaOH+O2↑ ④2Al+6HCl=2AlCl3+3H2↑ ⑤4Al+3O2 Na2O2 ③2Na2O2+2H2O=4NaOH+O2↑ ④2Al+6HCl=2AlCl3+3H2↑ ⑤4Al+3O2 Al2O3 ⑥Al2O3+6HCl=2AlCl3+3H2O,其中只有反应⑥为非氧化还原反应 Al2O3 ⑥Al2O3+6HCl=2AlCl3+3H2O,其中只有反应⑥为非氧化还原反应(4)2Na2O2+2H2O=4NaOH+O2↑ Al2O3+2NaOH=2NaAlO2+H2O,总反应为2 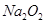 +2Al2O3===4 +2Al2O3===4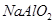 +O2↑ +O2↑(5)反应③2Na2O2+2H2O=4NaOH+O2↑为自身氧化还原反应,反应中有2个电子转移,若有 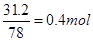 Na2O2参加反应,则转移的电子的物质的量为0.4mol Na2O2参加反应,则转移的电子的物质的量为0.4mol |
相似问题
(11分)某学生课外活动小组模拟呼吸面具中的反应原理设计用下图所示的仪器来制取氧气并测量氧气的体积。
(11分)某学生课外活动小组模拟呼吸面具中的反应原理设计用下图所示的仪器来制取氧气并测量氧气的体积。图中量气装置E由甲乙两根玻璃管组成,它们由橡皮管
将0.23 g金属钠投入到100 ml水中 使其充分反应 假设反应后溶液的体积不变。试计算:(1)反
将0 23 g金属钠投入到100 ml水中,使其充分反应,假设反应后溶液的体积不变。试计算:(1)反应后所得溶液溶质的物质的量浓度是多少?(2)产生标准状
①将0.100 L 1.00 mol·L-1的纯碱溶液逐滴滴入0.100 L 1.25 mol·L-
①将0.100 L 1.00 mol·L-1的纯碱溶液逐滴滴入0.100 L 1.25 mol·L-1的盐酸中;②将0.100 L 1.25 mol·L-1的盐酸逐滴滴入0.100 L 1
18.6g NaOH和Na2CO3的固体混合物投入200ml 2.0mol·L-1的盐酸中恰好完全反
18 6g NaOH和Na2CO3的固体混合物投入200ml 2 0mol·L-1的盐酸中恰好完全反应,不再产生气泡,则所得溶液中溶质的质量为()A.25 8gB.11 7gC.23 4gD.无法计算
下列有关Na2CO3和NaHCO3性质的比较中 正确的是 ( )A.热稳定性Na2CO3
下列有关Na2CO3和NaHCO3性质的比较中,正确的是 ( )A.热稳定性Na2CO3 < NaHCO3B.水溶性 Na2CO3 < NaHCO3 C.在它们等浓度的溶液中滴入稀盐酸,












